
【题目】可逆反应:2A(气) + 3B(气) ![]() 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
A.各物质的浓度之比为c(A):c(B):c(C) = 2:3:3
B.气体的总体积是反应开始时的 3/5
C.混合气体的密度不变
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0。下列叙述正确的是( )
Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A. 加入少量W,逆反应速率增大,正反应速率减小 B. 升高温度,平衡逆向移动
C. 当容器中气体压强不变时,反应达到平衡 D. 反应平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4 L H2O中含有的分子数为NA
B.1.7 g OH-中含有的质子数为NA
C.常温常压下,16 g O2中含有的氧原子数为NA
D.物质的量浓度为0.5 mol·L-1 MgCl2 溶液中,含有Cl-数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如图所示的变化。
气体A![]()
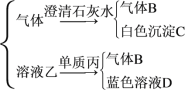
(1)写出下列物质的化学式:丙__,B___,C___,D___。
(2)写出甲跟乙反应的化学方程式:__。
(3)单质丙与溶液乙反应生成气体B的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】健康人体内含铁元素大约 2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含 Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

(1) 试剂1的名称是__________;试剂2的化学式为______________。
(2) 加入新制氯水,溶液中发生反应的离子方程式是_____________________________。
(3) 加入试剂2 时溶液为淡红色说明 “速力菲”中的 Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有___________性。
(4) 不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式________________________,现象为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。
(1)硒常用作光敏材料,基态硒原子的价电子排布图为__________;与硒同周期的p区元素中第一电离能大于硒的元素有__________种;SeO3的空间构型是_______________。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________________________________。
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是__________________,σ键和π键数目之比为_____________。
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为_____________,中心离子的配位数为________________。
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是__________________________________。
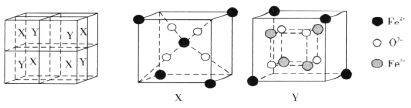
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为________________________。已知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则该品体的晶胞参数a=_______pm(用含d和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中错误的是

A. 此过程中铁被腐蚀
B. 此过程中电子从Fe移向Cu
C. 正极电极反应式为:2H++2e-===H2↑
D. 此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市为了减少燃煤造成的大气污染,对于作民用燃料的煤进行了多方面的改进。
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反应:FeS2+14FeCl3+8H2O=2FeSO4+13FeCl2+16HCl。
①该反应中的氧化剂是________,若有1 mol FeS2被除去,则发生转移的电子的物质的量是________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和氯气让废液重新利用生成FeCl3。请写出这一过程中有关的离子方程式:_____________。
(2)另一种方法是采用“固硫法”,即在燃料中加入生石灰,使含硫煤在燃烧时生成的SO2不能逸出而进入炉渣中,试用化学方程式表示这一“固硫”过程:_______、________。
(3)某城市采用了以油制气代替煤作民用燃料的做法。油制气的主要成分是丙烷,请写出其燃烧的化学方程式:_____________。
(4)绿色能源是人类的理想能源,不会造成环境污染,下列能源属于绿色能源的是________。
A 氢能源 B 太阳能 C 风能 D 石油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com