
【题目】某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列说法不正确的是
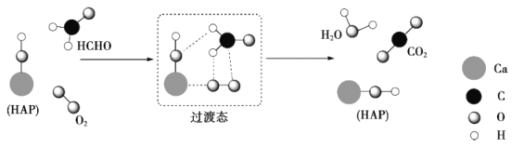
A.HAP能提高HCHO与O2的反应速率
B.根据图示信息,CO2分子中的氧原子全部来自O2
C.HCHO在反应过程中,有C-H键发生断裂
D.该反应可表示为: HCHO+O2![]() CO2+H2O
CO2+H2O
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种能在室温下高效催化空气中的甲醛氧化的催化剂,其反应如下:HCHO+O2 ![]() CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A.反应物和生成物都是非极性分子
B.HCHO 的空间构型为四面体形
C.HCHO、CO2 分子的中心原子的杂化类型不同
D.液态水中只存在一种作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可提高 SO2 的转化率
B.其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变
C.平衡前,充入氩气,容器内压强增大,反应速率加快
D.平衡时,其他条件不变,分离出硫,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是

A.Y点:![]() ,Z点:
,Z点:![]()
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,![]() 的平衡常数K的数量级为103
的平衡常数K的数量级为103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程(固定、加热及盛接仪器略)证明了海带中存在碘元素:

下列说法不正确的是
A.步骤①需要将干海带放入坩埚中灼烧
B.步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O
C.步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素
D.若步骤③加入的试剂是CCl4,振荡、静置后,液体分层,上层紫色,下层无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
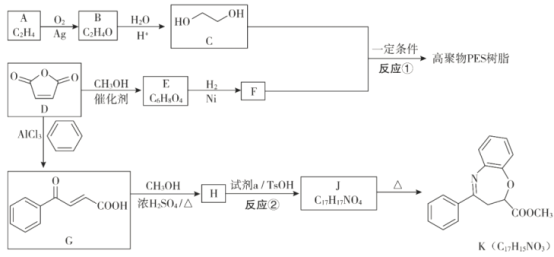
已知:
Ⅰ.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
Ⅱ.R1OH+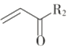
![]()
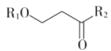
Ⅲ.R1NH2+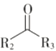
![]()
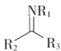 +H2O
+H2O
(R1、R2、R3代表烃基)
(1)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为___________。
(2)E分子中含有两个酯基,D生成E的化学方程式是__________。
(3)反应①的化学方程式为_____________。
(4)反应②所属的反应类型为___________。
(5)试剂a的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷催化裂解、氧气部分氧化和水煤气重整是目前制氢的常用方法。回答下列问题:
(1)甲烷隔绝空气分解,部分反应如下:
Ⅰ.CH4(g)=C(s)+2H2(g) H1=+74.9kJ/mol
Ⅱ.6CH4(g)=C6H6(g)+9H2(g) H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) H3=+202kJ/mol
①反应I的△S___(填“>”或“<”)0。
②![]() 的 △H=______kJ/mol。
的 △H=______kJ/mol。
(2)CH4用水蒸气重整制氢包含的反应为:
Ⅰ.水蒸气重整:![]()
Ⅱ.水煤气变换:![]()
平衡时各物质的物质的量分数如图所示:
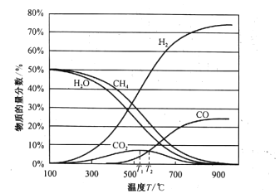
①为提高CH4的平衡转化率,除压强、温度外,还可采取的措施是___________(写一条)。
②温度高于T1℃时,CO2的物质的量分数开始减小,其原因是___________。
③T2℃时,容器中![]() ______________。
______________。
(3)甲烷部分氧化反应为![]() 。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
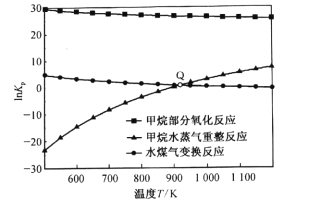
①图中Q点时,反应![]() 的InKp=________。
的InKp=________。
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1 atm。H2的平衡分压p(H2)=____atm;此温度下反应的lnKp=___(已知;ln3≈l.1,ln4≈l.4)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用两个石墨作电极,电解饱和Na2SO4溶液的装置,U形管内的电解液中事先加有酚酞指示剂。回答下列问题:
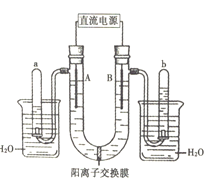
(1)根据图示中倒扣试管内的液面高度,判断直流电源左端为______极,Na+通过阳离子交换膜移动的方向为______(填“左→右”或“右→左”)。
(2)电解过程中,有关电极附近溶液颜色变化中正确的是______(填序号)。
①A管溶液由无色变为红色
②B管溶液由无色变为红色
③A管溶液不变色
④B管溶液不变色
(3)写出B管中发生的电极反应______。
(4)检验b管中气体的方法及现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是一种铜铁硫化物,化学式为CuFeS2,它是工业上炼铜的主要原料。某化学小组对其中的硫、铁、铜的含量进行测定。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。
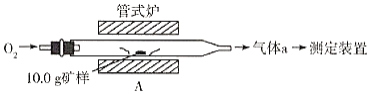
若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为__________。
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。

①KMnO4溶液氧化SO2的离子方程式为________________。
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为__________。
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是___________(填化学式);灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到________________。
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,其目的是_____
,其目的是_____
②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 molL-1 Na2S2O3标准溶液滴定生成的I2,以___________作指示剂。若消耗的Na2S2O3标准溶液为25.00 mL,则矿样中铜的质量分数是_________(已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com