
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
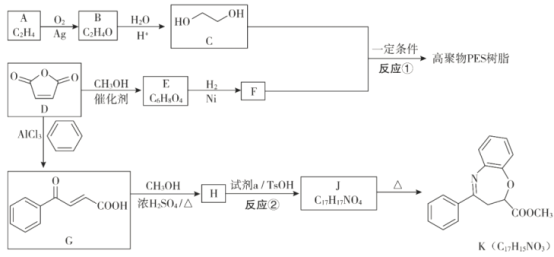
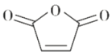
已知:
Ⅰ.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
Ⅱ.R1OH+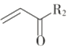
![]()
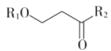
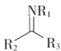
Ⅲ.R1NH2+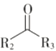
![]()
 +H2O
+H2O
(R1、R2、R3代表烃基)
(1)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为___________。
(2)E分子中含有两个酯基,D生成E的化学方程式是__________。
(3)反应①的化学方程式为_____________。
(4)反应②所属的反应类型为___________。
(5)试剂a的结构简式为_______________。
【答案】![]()
 +2CH3OH
+2CH3OH![]() H3COOCCH=CHCOOCH3+H2O n
H3COOCCH=CHCOOCH3+H2O n![]() +n
+n![]() →
→ +(2n-1)CH3OH 加成
+(2n-1)CH3OH 加成 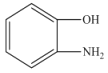
【解析】
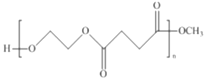
由A的分子式可确定A为CH2=CH2;由信息知,B为环氧乙烷![]() ;参照D的结构,E分子中含有两个酯基,则E为H3COOCCH=CHCOOCH3,F为H3COOCCH2CH2COOCH3;从而得出高聚物PES树脂的结构简式为
;参照D的结构,E分子中含有两个酯基,则E为H3COOCCH=CHCOOCH3,F为H3COOCCH2CH2COOCH3;从而得出高聚物PES树脂的结构简式为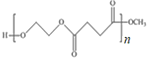 。由G的结构简式,可确定H为
。由G的结构简式,可确定H为![]() ;由J的分子式及K的结构,可确定J为
;由J的分子式及K的结构,可确定J为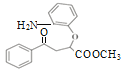 ,则试剂a为
,则试剂a为![]() 。
。
(1)B分子为环状结构,核磁共振氢谱只有一组峰,且B的分子式为C2H4O,从而得出B的结构简式为![]() 。答案为:
。答案为:![]() ;
;
(2)E分子中含有两个酯基,则E为H3COOCCH=CHCOOCH3,D生成E的化学方程式是![]() +2CH3OH
+2CH3OH![]() H3COOCCH=CHCOOCH3+H2O。答案为:
H3COOCCH=CHCOOCH3+H2O。答案为:![]() +2CH3OH
+2CH3OH![]() H3COOCCH=CHCOOCH3+H2O;
H3COOCCH=CHCOOCH3+H2O;
(3)反应①为![]() 与H3COOCCH=CHCOOCH3反应生成
与H3COOCCH=CHCOOCH3反应生成 ,化学方程式为n
,化学方程式为n![]() +n
+n![]() →
→ +(2n-1)CH3OH。答案为:n
+(2n-1)CH3OH。答案为:n![]() +n
+n![]() →
→ +(2n-1)CH3OH;
+(2n-1)CH3OH;
(4)反应②为![]() 与
与![]() 发生反应生成
发生反应生成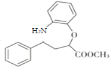 ,所属的反应类型为加成反应。答案为:加成;
,所属的反应类型为加成反应。答案为:加成;
(5)对比![]() 与
与 ,可确定试剂a的结构简式为
,可确定试剂a的结构简式为![]() 。答案为:
。答案为:![]() 。
。


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡 剂和密封剂。
(l) N2是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为________。
(2)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g)△H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol
4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol
△H=__________。
(3)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O
CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O![]() FeO+N2;反应②______________
FeO+N2;反应②______________
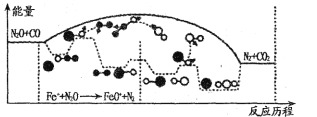
由图可知两步反应均为____(填“放热”或“吸热”)反应,由______(填“反应①或反应②”)决定反应达到平衡所用时间。
(4)在固定体积的密闭容器中,发生反应:N2O(g)+CO(g)![]() CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
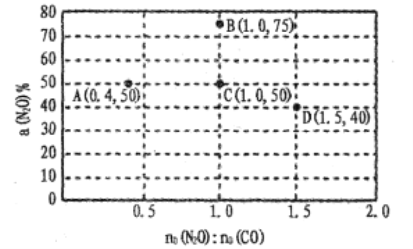
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是:____ ;
②图中C、D两点对应的实验温度分别为TC和TD,,通过计算判断TC____TD(填“>”“=”或“<”)。
(5)在某温度下,向1L密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数K=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A(g)+3B(g)![]() 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
A.v(A)=0.20 mol·(L·min)-1B.v(B)=0.45 mol·(L·s)-1
C.v(C)=0.30 mol·(L·min)-1D.v(D)=0.35 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种有机高分子,其合成路线如下:
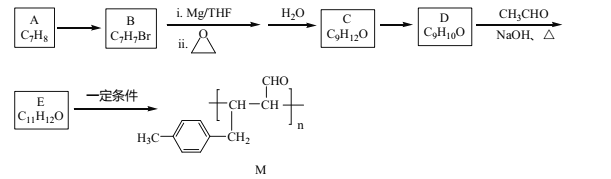
已知:①R-Br![]()
![]() R-CH2CH2OH
R-CH2CH2OH
②R-CHO![]() R-CH=CHCHO
R-CH=CHCHO
回答下列问题:
(1)A→B的反应试剂及条件是_______________。
(2)C→D的反应类型是_______________。
(3)化合物C的名称是_____________。
(4)D与银氨溶液反应的化学方程式为__________。
(5)E中官能团的名称是_______。
(6)化合物X(C10H10O)是E的同系物,且苯环上只有两个取代基,则X的同分异构体有______种,其中核磁共振氢谱为六组峰,峰面积之比为3:2:2:1:1:1的结构简式为________。
(7)设计由CH3Cl、环氧乙烷和乙醛制备CH3CH2CH=CHCHO的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列说法不正确的是
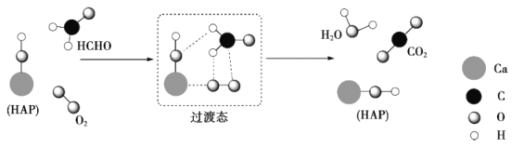
A.HAP能提高HCHO与O2的反应速率
B.根据图示信息,CO2分子中的氧原子全部来自O2
C.HCHO在反应过程中,有C-H键发生断裂
D.该反应可表示为: HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于室温下pH=2的盐酸和0.01molL-1的醋酸溶液,下列说法正确的是( )
A.两溶液中溶质的物质的量:n(CH3COOH)=n(HCl)
B.两溶液中阴离子的浓度:c(CH3COO-)<c(Cl-)
C.相同体积的两溶液均用水稀释100倍后,盐酸的pH比醋酸的大
D.相同体积的两溶液分别与足量镁条反应,盐酸产生的气体比醋酸的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
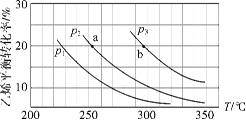
A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯代烃中不能由烯烃与氯化氢加成直接得到的有( )
A. 2一乙基—4—氯—1—丁烯 B. 氯代环己烷
C. 2,2,3,3—四甲基—1—氯丁烷 D. 3一甲基—3—氯戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠(Na2SnO3)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,一种由锡精矿制备锡酸钠的工艺流程如图:
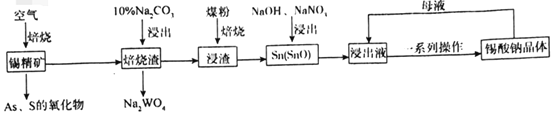
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②锡酸钠易溶于水,其溶解度随着温度的升高而降低。
请回答下列问题:
(1)Na2SnO3中锡元素的化合价为___,从焙烧渣中除去Fe3O4最简单的方法为___。
(2)WO3与Na2CO3溶液反应生成Na2WO4的化学方程式为___。
(3)加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___。
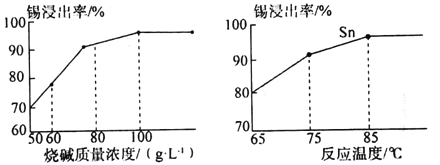
(4)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH的质量浓度和反应时间的关系图,则“碱浸”时最适宜条件为___、___。
(5)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___,将母液返回至浸出液的目的为___。
(6)碱性镀锡以NaOH和Na2SnO3为电解液,以纯锡为阳极材料,待镀金属为阴极材料,镀锡时阳极反应的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com