
【题目】化学反应A(g)+3B(g)![]() 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
A.v(A)=0.20 mol·(L·min)-1B.v(B)=0.45 mol·(L·s)-1
C.v(C)=0.30 mol·(L·min)-1D.v(D)=0.35 mol·(L·min)-1
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() ,俗称“保险粉”,属于一级遇湿易燃物品。
,俗称“保险粉”,属于一级遇湿易燃物品。![]() 易溶于水,难溶于乙醇,在碱性介质中可以稳定存在。如图是某兴趣小组利用锌粉法制备保险粉的装置示意图
易溶于水,难溶于乙醇,在碱性介质中可以稳定存在。如图是某兴趣小组利用锌粉法制备保险粉的装置示意图![]() 夹持、加热等装置略去
夹持、加热等装置略去![]() 。
。
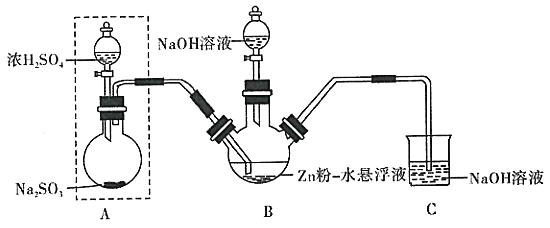
请回答有关问题:
(1)连接好仪器,检查虚线框内装置气密性良好的操作是________。A中发生反应的化学方程式为________。
(2)进入到B中的![]() 与Zn粉的水悬浮液在
与Zn粉的水悬浮液在![]() 反应生成
反应生成![]() ,需采用的加热方式为________。
,需采用的加热方式为________。
(3)将所得![]() 的悬浊液冷却至常温,加入NaOH溶液生成
的悬浊液冷却至常温,加入NaOH溶液生成![]() 和
和![]() 沉淀。欲使
沉淀。欲使![]() 沉淀完全,则需调节此溶液的pH至少为________
沉淀完全,则需调节此溶液的pH至少为________![]() 已知
已知![]() 。
。
(4)过滤出![]() 后,向所得滤液中加入适量的固体NaCl,经降温冷却、结晶过滤后再用乙醇洗涤,即可获得纯净的
后,向所得滤液中加入适量的固体NaCl,经降温冷却、结晶过滤后再用乙醇洗涤,即可获得纯净的![]() 晶体。加入固体NaCl的作用是________;用乙醇洗涤的优点是________。
晶体。加入固体NaCl的作用是________;用乙醇洗涤的优点是________。
(5)装置C的作用是________![]() 写两条
写两条![]() 。
。
(6)查阅资料:保险粉在空气中易吸收![]() 和
和![]() 生成
生成![]() 或
或![]() 和
和![]() 的混合物,请设计实验证明混合物中含有
的混合物,请设计实验证明混合物中含有![]() ,实验方案为________。
,实验方案为________。
(7)保险粉保存时应该置于________![]() 写出两项注意事项
写出两项注意事项![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的方程式正确的是
A.电解氯化镁溶液:2Cl–+2H2O![]() H2↑+Cl2↑+2OH–
H2↑+Cl2↑+2OH–
B.碳酸氢铵溶液中加入足量石灰水:Ca2++![]() +OH–=CaCO3↓+H2O
+OH–=CaCO3↓+H2O
C.Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化钡溶液中加入稀硫酸:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
B.对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
C.氨水中加入NaOH固体有利于氨气的溢出
D.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前三周期部分元素的原子序数与常见价态的关系图如下。若用原子序数表示对应元素,下列说法中不正确的是

A.a与d的非金属性比较:a> d
B.原子半径大小:b>c>a>d>e
C.a可以形成两种氢化物
D.b、c、e的最高价氧化物对应水化物之间均可反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液之间进行)中,ΔH2>ΔH1的是
A.CO2(s)+C(s)=2CO(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
B.NH3 ·H2O(aq)+H+(aq)= NH4+ (aq)+H2O(l) ΔH1 H+(aq)+OH-(aq)= H2O(aq) ΔH2
C.N2(g)+O2 (g) ![]() 2NO(g) △H1 N2(g)+O2 (g)
2NO(g) △H1 N2(g)+O2 (g) ![]() 2NO(g) △H2
2NO(g) △H2
D.CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) △H1 CH4(g)+2O2(g)= CO2(g)+ 2H2O(g) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道;D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
⑴F+离子的电子排布式是______。
⑵B、C、D元素的第一电离能由大到小的顺序是______。
⑶B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是______;B、C的这些氢化物的沸点相差较大的主要原因是______。
⑷A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是______;1mol该分子中含有![]() 键的数目是______。
键的数目是______。
⑸C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是______,C原子的配位数是______。
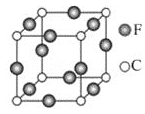
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(容器体积不变),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),下列事实能说明该分解反应达到化学平衡状态的是( )
2NH3(g)+CO2(g),下列事实能说明该分解反应达到化学平衡状态的是( )
A.2v正(NH3)=v逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均摩尔质量不变
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com