
【题目】下列事实不能用勒夏特列原理解释的是( )
A.反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
B.对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
C.氨水中加入NaOH固体有利于氨气的溢出
D.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
【答案】B
【解析】
A.反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度,平衡逆向移动,c(NO2)增大,体系颜色变深,能用勒夏特列原理解释,故A不选;
B.2HI(g) ![]() H2(g) +I2(g)两边气体计量数相等,增大压强,平衡不移动,但碘的浓度增大,颜色加深,不能用勒夏特列原理解释,故B选;
H2(g) +I2(g)两边气体计量数相等,增大压强,平衡不移动,但碘的浓度增大,颜色加深,不能用勒夏特列原理解释,故B选;
C.氨水中存在NH3 + H2O ![]() NH3·H2O
NH3·H2O![]() NH4++OH-,加入NaOH固体,氢氧根离子浓度增大,平衡逆向移动,有利于氨气的溢出,能用勒夏特列原理解释,故C不选;
NH4++OH-,加入NaOH固体,氢氧根离子浓度增大,平衡逆向移动,有利于氨气的溢出,能用勒夏特列原理解释,故C不选;
D.合成氨反应,N2(g)+3H2(g)═2NH3(g),△H<0,为提高氨的产率,理论上应采取降低温度的措施,有利于平衡向正反应方向移动,能用勒夏特列原理解释,故D不选;
故选B。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】25℃时,用0.1mol/L的NaOH溶液,分别滴定20mL、浓度均为0.1mol/L的两种酸HX、HY。所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A.0.1mol/L的一元酸HY在水中有1%发生电离
B.a点的导电能力比b点弱
C.b点溶液中,c(HY)+2c(H+)=c(Y-)+2c(OH-)
D.加NaOH溶液至pH=7时,两种溶液中,(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8的两种同分异构体X和Y。Y是一种芳香烃,分子中只有一个环;X俗称立方烷,其核磁共振氢谱显示只有一个吸收峰。下列有关说法错误的是( )
A.X、Y均能燃烧,都有大量浓烟产生
B.X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应
C.Y属于不饱和烃
D.X的二氯代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法不正确的是( )

A.燃料电池工作时,正极反应为O2+4H++4e﹣=2H2O
B.a极是铜,b极是铁时,可实现铁上镀铜
C.a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出的铜质量相等
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A(g)+3B(g)![]() 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
A.v(A)=0.20 mol·(L·min)-1B.v(B)=0.45 mol·(L·s)-1
C.v(C)=0.30 mol·(L·min)-1D.v(D)=0.35 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
B.常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
C.KHSO4在熔融状态下可导电:KHSO4 = K++H++SO42-
D.BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室探究过渡金属元素化合物的性质
I、铁及其化合物

(1)向FeSO4溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了图①装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。以上操作正确的顺序是:___。
(2)某实验小组称量3.60 g草酸亚铁晶体(FeC2O4·2H2O)加热过程中,固体质量变化如图②所示:
①请写出AB段发生反应的化学方程式:___。②C点成分为:___。
(3)向FeCl3溶液中加入过量Na2SO3溶液,设计实验证明两者发生了氧化还原反应并且为可逆反应。(简要说明实验步骤、现象和结论,仪器和药品自选)___。
II、铜及其化合物
向2ml0.2mol·L-1Na2SO3溶液中滴加0.2mol·L-1CuSO4溶液,发现溶液变绿,继续滴加产生棕黄色沉淀,经检验,棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+,Cu2+
Cu+Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
(4)用稀硫酸证实沉淀中含有Cu+的实验现象是___。
(5)向洗净的棕黄色沉淀中加入足量KI溶液,产生白色沉淀,继续向上层清液中加入淀粉溶液并没有变蓝的现象出现,请结合离子反应方程式解释不变蓝的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
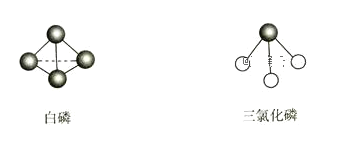
【题目】白磷和氯气反应生成PCl3的热化学方程式为P4(白磷,g)+6Cl2(g)═4PCl3(g) ΔH=-1326kJ·mol-1,已知化学键键能为Cl—Cl键243kJ·mol-1,P—Cl键331kJ·mol-1。白磷和PCl3的分子结构如图所示,则P—P键的键能为( )
A.396kJ·mol-1B.198kJ·mol-1
C.99kJ·mol-1D.49.5kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com