
【题目】25℃时,用0.1mol/L的NaOH溶液,分别滴定20mL、浓度均为0.1mol/L的两种酸HX、HY。所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A.0.1mol/L的一元酸HY在水中有1%发生电离
B.a点的导电能力比b点弱
C.b点溶液中,c(HY)+2c(H+)=c(Y-)+2c(OH-)
D.加NaOH溶液至pH=7时,两种溶液中,(X-)=c(Y-)
【答案】C
【解析】
A.0.1mol/L的酸HY的pH=4,则c(H+)=10-4mol/L,c(HY)=0.1mol/L,所以HY的电离度为(10-4mol/L÷0.1mol/L)×100%=0.1%,即0.1mol/L的一元酸HY在水中有0.1%发生电离,A错误;
B.反应开始时HX溶液的pH=1,c(H+)=c(HX)=0.1mol/L,所以HX是强酸,完全电离,而HY是一元弱酸,部分电离,存在电离平衡,当加入NaOH溶液体积相等都是10mL时,HY中仍然有大量HY分子存在,离子浓度比HX的小,所以a点的导电能力比b点强,B错误;
C.b点溶液中含有等物质的量浓度的HY和NaY,根据电荷守恒可得:c(Na+)+c(H+)=c(Y-)+c(OH-),根据物料守恒可得2c(Na+)=c(HY)+ c(Y-),第一个式子扩大2倍,然后减去第二个式子,整理可得c(HY)+2c(H+)=c(Y-)+2c(OH-),C正确;
D.pH=7时,根据电荷守恒,HY反应后的溶液中c(Na+)=c(Y-);HX反应后的溶液中c(Na+)=c(X-),又由于HX是强酸,HY是弱酸,部分电离,HX消耗的NaOH多,所以c(X-)>c(Y-),D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:![]()
B.含有AgCl和AgI固体的悬浊液:![]()
C.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中:![]() 大小顺序:①>②>③
大小顺序:①>②>③
D.含等物质的量的NaHC2O4和Na2C2O4的溶液(H2C2O4为二元弱酸):![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
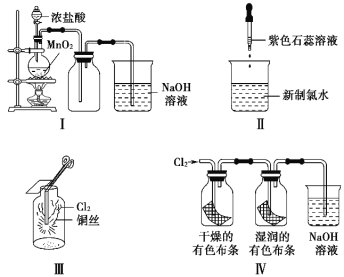
A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水只有酸性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
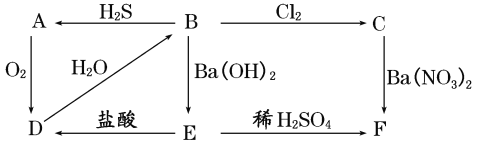
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组设计的下列实验合理的是


A. 配置一定浓度的硫酸 B. 制备少量氨气
C. 制备并收集少量NO2气体 D. 制备少量氧气,并随关随停
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和氯气,用光照射烧瓶一段时间,下列说法正确的是( )
![]()
A. 只能生成CH3Cl一种有机物
B. 烧瓶内液面不可能上升
C. 大试管内的液体可能会分层
D. 向水中加入石蕊试液后不变色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)SO2在烟尘的催化下形成硫酸的反应方程式是______________.
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
①写出NO2和SO2反应的热化学方程式为_________.
②随温度升高,该反应化学平衡常数变化趋势是_____.
(3)提高2SO2+O22SO3反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在1L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是____.
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____(填字母).
a.温度和容器体积不变,充入1.0mol He b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图。

①电解饱和食盐水的化学方程式是________________.
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_________.
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气的性质,按下图装置进行实验,制取氨气的原理:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,下列说法不正确的是( )
CaCl2+2NH3↑+2H2O,下列说法不正确的是( )
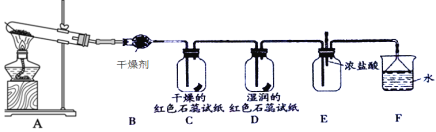
A.装置B中的干燥剂可以是P2O5B.装置C中的试纸不变色,D中试纸变蓝色
C.在装置E中滴入几滴浓盐酸会出现白烟D.装置F中的漏斗能起防倒吸作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com