
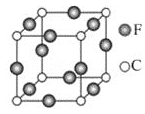
ЁОЬтФПЁПAЁЂBЁЂCЁЂDЁЂEЁЂFСљжждЊЫиОљЮЛгкжмЦкБэЕФЧАЫФжмЦкЃЌЧвдзгађЪ§вРДЮдіДѓЁЃдЊЫиAЪЧдзгАыОЖзюаЁЕФдЊЫиЃЛBдЊЫиЛљЬЌдзгЕФКЫЭтЕчзгЗжеМЫФИідзгЙьЕРЃЛDдЊЫидзгЕФвбГЩЖдЕчзгзмЪ§ЪЧЮДГЩЖдЕчзгзмЪ§ЕФ3БЖЃЛEгыDДІгкЭЌвЛжїзхЃЛFЮЛгкdsЧјЃЌЧвдзгЕФзюЭтВужЛга1ИіЕчзгЁЃ
ЂХF+РызгЕФЕчзгХХВМЪНЪЧ______ЁЃ
ЂЦBЁЂCЁЂDдЊЫиЕФЕквЛЕчРыФмгЩДѓЕНаЁЕФЫГађЪЧ______ЁЃ
ЂЧBЁЂCдЊЫиЕФФГаЉЧтЛЏЮяЕФЗжзгжаОљКЌга18ИіЕчзгЃЌдђBЕФетжжЧтЛЏЮяЕФЛЏбЇЪНЪЧ______ЃЛBЁЂCЕФетаЉЧтЛЏЮяЕФЗаЕуЯрВюНЯДѓЕФжївЊдвђЪЧ______ЁЃ
ЂШAЁЂBЁЂDПЩаЮГЩЗжзгЪНЮЊA2BDЕФФГЛЏКЯЮяЃЌдђИУЛЏКЯЮяЗжзгжаBдзгЕФЙьЕРдгЛЏРраЭЪЧ______ЃЛ1molИУЗжзгжаКЌга![]() МќЕФЪ§ФПЪЧ______ЁЃ
МќЕФЪ§ФПЪЧ______ЁЃ
ЂЩCЁЂFСНдЊЫиаЮГЩЕФФГЛЏКЯЮяЕФОЇАћНсЙЙШчЭМЫљЪОЃЌдђИУЛЏКЯЮяЕФЛЏбЇЪНЪЧ______ЃЌCдзгЕФХфЮЛЪ§ЪЧ______ЁЃ
ЁОД№АИЁП1s22s22p63s23p63d10Лђ[Ar]3d10 N > O > C C2H6 ЕЊЕФЧтЛЏЮя(N2H4)ЗжзгМфДцдкЧтМќ sp2 NA Cu3N 6
ЁОНтЮіЁП
AЁЂBЁЂCЁЂDЁЂEЁЂFСљжждЊЫиОљЮЛгкжмЦкБэЕФЧАЫФжмЦкЃЌЧвдзгађЪ§вРДЮдіДѓЃЛдЊЫиAЪЧдзгАыОЖзюаЁЕФдЊЫиЃЌдђAЪЧHдЊЫиЃЛBдЊЫиЛљЬЌдзгЕФКЫЭтЕчзгЗжеМЫФИідзгЙьЕРЃЌдђBЮЊCдЊЫиЃЛDдЊЫидзгЕФвбГЩЖдЕчзгзмЪ§ЪЧЮДГЩЖдЕчзгзмЪ§ЕФ3БЖЃЌдђDЪЧOдЊЫиЃЌCдЊЫидзгађЪ§ДѓгкBЖјаЁгкDЃЌдђCЪЧNдЊЫиЃЛEгыDДІгкЭЌвЛжїзхЃЌдђEЪЧSдЊЫиЃЛFЮЛгкdsЧјЃЌЧвдзгЕФзюЭтВужЛга1ИіЕчзгЃЌдђFЮЊCuдЊЫиЃЛ
ЂХCu+ЪЧCuдзгЪЇШЅзюЭтВуЕчзгЕУЕНЕФРызгЃЌЦфРызгКЫЭтга28ИіЕчзгЃЌИљОнЙЙдьдРэЪщаДбЧЭРызгКЫЭтЕчзгХХВМЪНЮЊ1s22s22p63s23p63d10Лђ[Ar]3d10ЃЌЙЪД№АИЮЊЃК1s22s22p63s23p63d10Лђ[Ar]3d10ЃЛ
ЂЦBЁЂCЁЂDЗжБ№ЪЧCЁЂNЁЂOдЊЫиЃЌЧвЮЛгкЭЌвЛжмЦкЃЌЭЌвЛжмЦкдЊЫиЕквЛЕчРыФмЫцзХдзгађЪ§діДѓЖјГЪдіДѓЧїЪЦЃЌЕЋЕкIIAзхЁЂЕкVAзхдЊЫиЕквЛЕчРыФмДѓгкЦфЯрСкдЊЫиЃЌЫљвдетШ§жждЊЫиЕквЛЕчРыФмДѓаЁЫГађЪЧN > O > CЃЌЙЪД№АИЮЊЃКN > O > CЃЛ
ЂЧCЁЂNдЊЫиЕФФГаЉЧтЛЏЮяЕФЗжзгжаОљКЌга18ИіЕчзгЃЌдђBЕФетжжЧтЛЏЮяЮЊC2H6ЃЛКЌгаЧтМќЕФЧтЛЏЮяШлЗаЕуНЯИпЃЌN2H4жаКЌгаЧтМќЖјC2H6жаВЛКЌЧтМќЃЌЫљвдЕЊЕФЧтЛЏЮяШлЗаЕуНЯИпЃЌЙЪД№АИЮЊЃКC2H6ЃЛЕЊЕФЧтЛЏЮяN2H4ЗжзгМфДцдкЧтМќЃЛ
ЂШHЁЂCЁЂOПЩаЮГЩЗжзгЪНЮЊH2COЕФФГЛЏКЯЮяЃЌЮЊHCHOЃЌИУЗжзгжаCдзгМлВуЕчзгЖдИіЪ§ЪЧ3ЧвВЛКЌЙТЕчзгЖдЃЌИљОнМлВуЕчзгЖдЛЅГтРэТлХаЖЯCдзгдгЛЏЗНЪНЮЊsp2ЃЛвЛИіМзШЉЗжзгжаКЌга1ИіІаМќЃЌдђ1molМзШЉжаКЌга1molІаМќЃЌЪ§ФПЮЊNAЃЌЙЪД№АИЮЊЃКsp2ЃЛNAЁЃ
ЂЩNЁЂCuСНдЊЫиаЮГЩЕФФГЛЏКЯЮяЕФОЇАћНсЙЙШчЭМЫљЪОЃЌИУОЇАћжаCuдзгИіЪ§![]() ЁЂNдзгИіЪ§
ЁЂNдзгИіЪ§![]() ЃЌЫљвдЦфЛЏбЇЪНЮЊCu3NЃЛИУОЇАћжаNдзгХфЮЛЪ§ЮЊ6ЃЌЙЪД№АИЮЊЃКCu3NЃЛ6ЁЃ
ЃЌЫљвдЦфЛЏбЇЪНЮЊCu3NЃЛИУОЇАћжаNдзгХфЮЛЪ§ЮЊ6ЃЌЙЪД№АИЮЊЃКCu3NЃЛ6ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщВйзїФмДяЕНЯргІЪЕбщФПЕФЕФЪЧ
бЁЯю | ЪЕбщФПЕФ | ЪЕбщВйзї |
A | ЬНОПI-гыFe2+ЕФЛЙдадЧПШѕ | ЯђFeCl3ЯЁШмвКжавРДЮМгШыKIШмвКЁЂЕэЗл |
B | ЬНОПHPO42-дкЫЎШмвКжаЕФЕчРыГЬЖШгыЫЎНтГЬЖШЕФЯрЖдДѓаЁ | ВтЖЈ0.1 molЁЄL-1NaH2PO4ШмвКЕФpH |
C | ХфжЦ0.1 molЁЄL-1СкБНЖўМзЫсЧтМи( | ГЦШЁ5.1 gСкБНЖўМзЫсЧтМигкЩеБжа,МгШыЩйСПеєСѓЫЎШмНт,зЊвЦжС500 mLШнСПЦПжаЖЈШн |
D | БШНЯCaCO3КЭCaSO4ЕФKspДѓаЁ | ЯђГЮЧхЪЏЛвЫЎжаЕЮШы0.1 molЁЄL-1Na2CO3ШмвКжСВЛдйгаГСЕэВњЩњ,дйЕЮМг0.1 molЁЄL-1Na2SO4ШмвК |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇЗДгІA(g)+3B(g)![]() 2C(g)+2D(g)ЃЌдкЯТСаЫФИібЁЯюжаЪЧВЛЭЌЕФЧщПіЯТВтЕУЕФВЛЭЌЮяжЪЕФЗДгІЫйТЪЃЌЦфжаБэЪОИУЛЏбЇЗДгІЕФЗДгІЫйТЪзюТ§ЕФЪЧ(ЁЁЁЁ)
2C(g)+2D(g)ЃЌдкЯТСаЫФИібЁЯюжаЪЧВЛЭЌЕФЧщПіЯТВтЕУЕФВЛЭЌЮяжЪЕФЗДгІЫйТЪЃЌЦфжаБэЪОИУЛЏбЇЗДгІЕФЗДгІЫйТЪзюТ§ЕФЪЧ(ЁЁЁЁ)
A.v(A)=0.20 molЁЄ(LЁЄmin)-1B.v(B)=0.45 molЁЄ(LЁЄs)-1
C.v(C)=0.30 molЁЄ(LЁЄmin)-1D.v(D)=0.35 molЁЄ(LЁЄmin)-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮТЖШЮЊTЪБЃЌЯђ2.0 LКуШнУмБеШнЦїжаГфШы1.0 mol PCl5ЃЌЗЂЩњЗДгІЃКPCl5(g)![]() PCl3(g)ЃЋCl2(g)ЁЁІЄH=a kJЁЄmolЃ1(aЃО0)ЁЃ0ЁЋ10 minБЃГжШнЦїЮТЖШВЛБфЃЌ10 minЪБИФБфвЛжжЬѕМўЃЌећИіЙ§ГЬжаPCl5ЁЂPCl3ЁЂCl2ЕФЮяжЪЕФСПЫцЪБМфЕФБфЛЏШчЭМЫљЪОЁЃ
PCl3(g)ЃЋCl2(g)ЁЁІЄH=a kJЁЄmolЃ1(aЃО0)ЁЃ0ЁЋ10 minБЃГжШнЦїЮТЖШВЛБфЃЌ10 minЪБИФБфвЛжжЬѕМўЃЌећИіЙ§ГЬжаPCl5ЁЂPCl3ЁЂCl2ЕФЮяжЪЕФСПЫцЪБМфЕФБфЛЏШчЭМЫљЪОЁЃ

ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.0ЁЋ4 minЕФЦНОљЫйТЪv(PCl3)=0.025 molЁЄLЃ1ЁЄminЃ1
B.10 minЪБИФБфЕФЬѕМўЪЧдіМгСЫвЛЖЈСПЕФPCl5
C.ШєЦ№ЪМЪБЯђИУШнЦїжаГфШы2.0 mol PCl3КЭ2.0 mol Cl2ЃЌБЃГжЮТЖШЮЊTЃЌЗДгІДяЦНКтЪБЗХГіЕФШШСПаЁгк1.6a kJ
D.ЮТЖШЮЊTЃЌЦ№ЪМЪБЯђИУШнЦїжаГфШы1.0 mol PCl5ЁЂ0.10 mol PCl3КЭ0.10 mol Cl2ЃЌЗДгІДяЕНЦНКтЧАvе§ЃМvФц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщдкЪЕбщЪвЬНОПЙ§ЖЩН№ЪєдЊЫиЛЏКЯЮяЕФаджЪ
IЁЂЬњМАЦфЛЏКЯЮя

ЃЈ1ЃЉЯђFeSO4ШмвКжаЕЮМгNaOHШмвКЃЌВњЩњАзЩЋГСЕэЃЌЕЋбИЫйБфЮЊЛвТЬЩЋЃЌзюжеБфЮЊКьКжЩЋЃЌЮЊЫГРћПДЕННЯГЄЪБМфЕФАзЩЋГСЕэЃЌЩшМЦСЫЭМЂйзАжУЃКЂйМьВщзАжУЦјУмадЃЌзАШывЉЦЗЃЛЂкДђПЊжЙЫЎМаKЃЛЂлдкЪдЙмbГіПкЪеМЏЦјЬхВЂбщДПЃЛЂмЙиБежЙЫЎМаKЁЃвдЩЯВйзїе§ШЗЕФЫГађЪЧЃК___ЁЃ
ЃЈ2ЃЉФГЪЕбщаЁзщГЦСП3.60 gВнЫсбЧЬњОЇЬх(FeC2O4ЁЄ2H2O)МгШШЙ§ГЬжаЃЌЙЬЬхжЪСПБфЛЏШчЭМЂкЫљЪОЃК
ЂйЧыаДГіABЖЮЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЃК___ЁЃЂкCЕуГЩЗжЮЊЃК___ЁЃ
ЃЈ3ЃЉЯђFeCl3ШмвКжаМгШыЙ§СПNa2SO3ШмвКЃЌЩшМЦЪЕбщжЄУїСНепЗЂЩњСЫбѕЛЏЛЙдЗДгІВЂЧвЮЊПЩФцЗДгІЁЃ(МђвЊЫЕУїЪЕбщВНжшЁЂЯжЯѓКЭНсТлЃЌвЧЦїКЭвЉЦЗздбЁ)___ЁЃ
IIЁЂЭМАЦфЛЏКЯЮя
Яђ2ml0.2molЁЄLЃ1Na2SO3ШмвКжаЕЮМг0.2molЁЄLЃ1CuSO4ШмвКЃЌЗЂЯжШмвКБфТЬЃЌМЬајЕЮМгВњЩњзиЛЦЩЋГСЕэЃЌОМьбщЃЌзиЛЦЩЋГСЕэжаВЛКЌSO42ЃЃЌКЌгаCuЃЋЁЂCu2ЃЋКЭSO32ЃЁЃ
вбжЊЃКCuЃЋ![]() CuЃЋCu2ЃЋЃЌCu2ЃЋ
CuЃЋCu2ЃЋЃЌCu2ЃЋ![]() CuIЁ§(АзЩЋ)ЃЋI2ЁЃ
CuIЁ§(АзЩЋ)ЃЋI2ЁЃ
ЃЈ4ЃЉгУЯЁСђЫсжЄЪЕГСЕэжаКЌгаCuЃЋЕФЪЕбщЯжЯѓЪЧ___ЁЃ
ЃЈ5ЃЉЯђЯДОЛЕФзиЛЦЩЋГСЕэжаМгШызуСПKIШмвКЃЌВњЩњАзЩЋГСЕэЃЌМЬајЯђЩЯВуЧхвКжаМгШыЕэЗлШмвКВЂУЛгаБфРЖЕФЯжЯѓГіЯжЃЌЧыНсКЯРызгЗДгІЗНГЬЪННтЪЭВЛБфРЖЕФдвђ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕНФПЧАЮЊжЙЃЌгЩЛЏбЇФмзЊБфЕФШШФмЛђЕчФмШдШЛЪЧШЫРрЪЙгУЕФзюжївЊЕФФмдДЁЃ
(1)дк25ЁцЁЂ101kPaЯТЃЌ16gЕФМзДМ(CH3OH)ЭъШЋШМЩеЩњГЩCO2КЭвКЬЌЫЎЪБЗХГі352kJЕФШШСПЃЌдђБэЪОМзДМШМЩеШШЕФШШЛЏбЇЗНГЬЪНЮЊ______ЁЃ
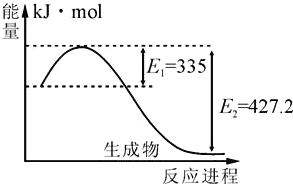
(2)ЛЏбЇЗДгІжаЗХГіЕФШШФм(ьЪБфЃЌЁїH)гыЗДгІЮяКЭЩњГЩЮяЕФМќФм(E)гаЙиЁЃвбжЊЃКH2(g)+Cl2(g)=2HCl(g) ЁїH=Љ185kJ/molЃЌE(HЉCl)=432kJ/molЃЌE(ClЉCl)=243kJ/molдђE(HЉH)=_____ЁЃ
(3)ФЩУзМЖCu2OгЩгкОпгагХСМЕФДпЛЏадФмЖјЪмЕНЙизЂЃЎвбжЊЃК2Cu(s)+ ![]() O2(g)ЈTCu2O(s)ЁїH=Љ169kJmolЉ1ЃЌC(s)+
O2(g)ЈTCu2O(s)ЁїH=Љ169kJmolЉ1ЃЌC(s)+ ![]() O2(g)ЈTCO(g)ЁїH=Љ110.5kJmolЉ1ЃЌ2Cu(s)+O2(g)ЈT2CuO(s)ЁїH=Љ314kJmolЉ1ЃЌдђЙЄвЕЩЯгУЬПЗлдкИпЮТЬѕМўЯТЛЙдCuOжЦШЁCu2OКЭCOЕФШШЛЏбЇЗНГЬЪН_____ЁЃ
O2(g)ЈTCO(g)ЁїH=Љ110.5kJmolЉ1ЃЌ2Cu(s)+O2(g)ЈT2CuO(s)ЁїH=Љ314kJmolЉ1ЃЌдђЙЄвЕЩЯгУЬПЗлдкИпЮТЬѕМўЯТЛЙдCuOжЦШЁCu2OКЭCOЕФШШЛЏбЇЗНГЬЪН_____ЁЃ
(4)ШчЭМЪЧN2(g)КЭH2(g)ЗДгІЩњГЩ2molNH3(g)Й§ГЬжаФмСПБфЛЏЪОвтЭМЃК
ЂйЧыМЦЫуУПЩњГЩ1molNH3ЗХГіШШСПЮЊЃК______ЁЃ
ЂкШєЦ№ЪМЪБЯђШнЦїФкГфШы1molN2КЭ3molH2ДяЦНКтКѓN2ЕФзЊЛЏТЪЮЊ20%ЃЌдђЗДгІЗХГіЕФШШСПЮЊQ1kJЃЌдђQ1ЕФЪ§жЕЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫЎзЪдДЗЧГЃживЊЃЌСЊКЯЙњШЗЖЈ2003ФъЮЊЙњМЪЕЫЎФъЃЎКЃЫЎЕЛЏЪЧКЃЕКЕиЧјЬсЙЉЕЫЎЕФживЊЪжЖЮЃЌЫљЮНКЃЫЎЕЛЏЪЧжИГ§ШЅКЃЫЎжаЕФбЮЗжвдЛёЕУЕЫЎЕФЙЄвеЙ§ГЬ![]() гжГЦКЃЫЎЭббЮ
гжГЦКЃЫЎЭббЮ![]() ЃЌЦфЗНЗЈНЯЖрЃЌШчЗДЩјЭИЗЈЁЂЫЎКЯЮяЗЈЁЂЕчЩјЭИЗЈЁЂРызгНЛЛЛЗЈКЭбЙЩјЗЈЕШЃЎЯТСаЗНЗЈжавВПЩвдгУРДНјааКЃЫЎЕЛЏЕФЪЧ
ЃЌЦфЗНЗЈНЯЖрЃЌШчЗДЩјЭИЗЈЁЂЫЎКЯЮяЗЈЁЂЕчЩјЭИЗЈЁЂРызгНЛЛЛЗЈКЭбЙЩјЗЈЕШЃЎЯТСаЗНЗЈжавВПЩвдгУРДНјааКЃЫЎЕЛЏЕФЪЧ
A.Й§ТЫЗЈB.еєСѓЗЈC.нЭШЁЗЈD.еєЗЂЗЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЯТЭМЃЌФГЦјЬхXПЩФмгЩH2ЁЂCOЁЂCH4жаЕФвЛжжЛђМИжжзщГЩЁЃНЋXЦјЬхШМЩеЃЌАбШМЩеКѓЩњГЩЕФЦјЬхЭЈЙ§AЁЂBСНИіЯДЦјЦПЁЃЪдЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉШєAЯДЦјЦПЕФжЪСПдіМгЃЌBЯДЦјЦПЕФжЪСПВЛБфЃЌдђЦјЬхXЪЧ____________ЁЃ
ЃЈ2ЃЉШєAЯДЦјЦПЕФжЪСПВЛБфЃЌBЯДЦјЦПЕФжЪСПдіМгЃЌдђЦјЬхXЪЧ____________ЁЃ
ЃЈ3ЃЉШєAЁЂBСНИіЯДЦјЦПЕФжЪСПЖМдіМгЃЌдђЦјЬхXПЩФмЪЧ____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЬѕМўЯТЃЌЖўбѕЛЏСђКЭбѕЦјЗЂЩњШчЯТЗДгІЃК2SO2ЃЈgЃЉ+O2ЃЈgЃЉ2SO3ЃЈgЃЉ ЁїHЃМ0;
(1)аДГіИУЗДгІЕФЛЏбЇЦНКтГЃЪ§БэДяЪНK=__________
(2)НЕЕЭЮТЖШЃЌИУЗДгІKжЕ__________ЃЌЖўбѕЛЏСђзЊЛЏТЪ___________ЃЌЛЏбЇЗДгІЫйТЪ___________ЃЈвдЩЯОљЬюдіДѓЁЂМѕаЁЛђВЛБфЃЉЁЃ
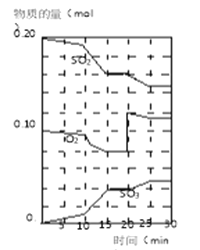
(3)600ЁцЪБЃЌдквЛУмБеШнЦїжаЃЌНЋЖўбѕЛЏСђКЭбѕЦјЛьКЯЃЌЗДгІЙ§ГЬжаSO2ЁЂO2ЁЂSO3ЮяжЪЕФСПБфЛЏШчЭМЃЌЗДгІДІгкЦНКтзДЬЌЪБМфЪЧ___________________________ЁЃ
(4)ОнЭМХаЖЯЃЌЗДгІНјаажС20minЪБЃЌЧњЯпЗЂЩњБфЛЏЕФдвђЪЧ_______________________ЃЈгУЮФзжБэДяЃЉЁЃ
(5)10minЕН15minЕФЧњЯпБфЛЏЕФдвђПЩФмЪЧ____________ЃЈЬюаДБрКХЃЉЁЃ
AЁЂМгСЫДпЛЏМС BЁЂЫѕаЁШнЦїЬхЛ§
CЁЂНЕЕЭЮТЖШ DЁЂдіМгSO3ЕФЮяжЪЕФСПЁЃ
(6)ШєИУЗДгІЕФУмБеШнЦїЮЊ2LЃЌдђЗДгІ15minЪБЃЌvЃЈSO2ЃЉ=___________
(7)ЮЊЪЙИУЗДгІЕФЗДгІЫйТЪдіДѓЃЌЧвЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЕФЪЧЃЈ____ЃЉ
AЁЂМАЪБЗжРыГіSO3ЦјЬхBЁЂЪЪЕБЩ§ИпЮТЖШ
CЁЂдіДѓO2ЕФХЈЖШ DЁЂбЁдёИпаЇЕФДпЛЏМС
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com