
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为______。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,E(H﹣Cl)=432kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣H)=_____。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
(4)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化示意图:
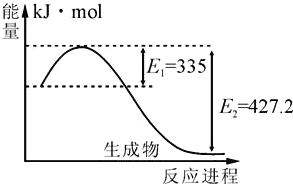
①请计算每生成1molNH3放出热量为:______。
②若起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________。
【答案】CH3OH(l)+![]() O2(g) =CO2(g)+H2O(l) △H=﹣704kJ/mol 436 kJ/mol C(s) +2 CuO (s) == Cu2O(s) +CO(g) △H=+34.5kJ/mol 41.6 kJ 18.44
O2(g) =CO2(g)+H2O(l) △H=﹣704kJ/mol 436 kJ/mol C(s) +2 CuO (s) == Cu2O(s) +CO(g) △H=+34.5kJ/mol 41.6 kJ 18.44
【解析】
(1)依据燃烧热的概念,是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据题干所给量计算1mol甲醇燃烧生成二氧化碳和液态水放出的热量,再书写反应的热化学方程式;
(2)根据反应热=反应物总键能-生成物总键能计算;
(3)根据盖斯定律分析解答;
(4)①△H=反应物的活化能-生成物的活化能计算生成2mol氨气放出的能量,再计算得到1mol氨气放出的热量;②依据氮气的转化率计算生成氨气的物质的量,结合热化学方程式计算Q1。
(1)在25℃、101kPa下,16g甲醇(CH3OH)燃烧生成CO2和液态水时放热352kJ,32g甲醇燃烧生成二氧化碳和液态水放出热量为704kJ,则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-704kJmol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=-704kJmol-1,故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-704kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-704kJmol-1;
(2) △H=反应物总键能-生成物总键能=E(H﹣H)+243kJ/mol-2×432kJ/mol =-185kJ/mol,解得E(H-H)=436kJ/mol,故答案为:436 kJ/mol;
(3)①2Cu(s)+![]() O2(g)═Cu2O(s) △H=-169kJmol-1,②C(s)+
O2(g)═Cu2O(s) △H=-169kJmol-1,②C(s)+![]() O2(g)═CO(g) △H=-110.5kJmol-1,③2Cu(s)+O2(g)═CuO(s) △H=-314kJmol-1,用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO(s)=Cu(s)+CO(g),根据盖斯定律,将②-③-
O2(g)═CO(g) △H=-110.5kJmol-1,③2Cu(s)+O2(g)═CuO(s) △H=-314kJmol-1,用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO(s)=Cu(s)+CO(g),根据盖斯定律,将②-③-![]() ×①,反应的焓变为-110.5kJmol-1-(-314kJmol-1)-
×①,反应的焓变为-110.5kJmol-1-(-314kJmol-1)- ![]() ×(-169kJmol-1)=34.5kJmol-1,故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g) △H=+34.5kJmol-1;
×(-169kJmol-1)=34.5kJmol-1,故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g) △H=+34.5kJmol-1;
(4)①如图是N2和H2反应生成2molNH3过程中能量变化示意图,反应焓变△H=反应物的活化能-生成物的活化能=335kJ/mol-427.2kJ/mol=-92.2kJ/mol,所以生成1mol氨气放热46.1kJ,故答案为:46.1kJ;
②如图是N2和H2反应生成2molNH3过程中能量变化示意图,反应焓变△H=335kJ/mol-427.2kJ/mol=-92.2kJ/mol,起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,生成氨气的物质的量为1mol ×20%×2=0.4mol,生成0.4mol氨气放出的热量=![]() ×92.2kJ=18.44kJ,故答案为:18.44。
×92.2kJ=18.44kJ,故答案为:18.44。


科目:高中化学 来源: 题型:
【题目】室温下,一气态烃与过量氧气混合完全燃烧,恢复到室温,使燃烧产物通过浓硫酸,体积比反应前减少50mL,再通过NaOH溶液,体积又减少了40mL,原烃的分子式是( )
A.CH4B.C2H4C.C2H6D.C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前三周期部分元素的原子序数与常见价态的关系图如下。若用原子序数表示对应元素,下列说法中不正确的是

A.a与d的非金属性比较:a> d
B.原子半径大小:b>c>a>d>e
C.a可以形成两种氢化物
D.b、c、e的最高价氧化物对应水化物之间均可反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) →PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0064 mol/(L·s)
B.若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的△H﹤0
C.相同温度下,起始时向该容器中充入 4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于 80%
D.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道;D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
⑴F+离子的电子排布式是______。
⑵B、C、D元素的第一电离能由大到小的顺序是______。
⑶B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是______;B、C的这些氢化物的沸点相差较大的主要原因是______。
⑷A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是______;1mol该分子中含有![]() 键的数目是______。
键的数目是______。
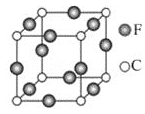
⑸C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是______,C原子的配位数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素。已知:①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是__________________________;A、B、D、E四种元素的第一电离能由大到小的顺序为________________(用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是________________。分子的立体构型为________________,该氢化物易溶于D的简单氢化物的主要原因是________________。
(3)D原子分别与A、B原子形成的单键中,键的极性较强是________________(用具体的化学键表示)。
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是_______。

a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示:
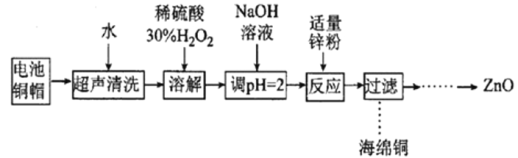
下列叙述错误的是
A. 合理处理废弃旧电池的铜帽既有利于节约资源,又有利于保护环境
B. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
C. 加入锌粉反应的离子为Cu2+
D. “过滤”操作后直接将溶液蒸发结晶、高温灼烧得到ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
①溴水中存在化学平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②实验室制取CO2时,粉碎大理石有利于CO2的生成
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④反应CO(g)+NO2(g)![]() CO2(g)+NO(g) ΔH<0,达化学平衡后,升高温度体系的颜色加深
CO2(g)+NO(g) ΔH<0,达化学平衡后,升高温度体系的颜色加深
A.①④B.②③C.①②D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com