
【题目】下列实验操作能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究I-与Fe2+的还原性强弱 | 向FeCl3稀溶液中依次加入KI溶液、淀粉 |
B | 探究HPO42-在水溶液中的电离程度与水解程度的相对大小 | 测定0.1 mol·L-1NaH2PO4溶液的pH |
C | 配制0.1 mol·L-1邻苯二甲酸氢钾( | 称取5.1 g邻苯二甲酸氢钾于烧杯中,加入少量蒸馏水溶解,转移至500 mL容量瓶中定容 |
D | 比较CaCO3和CaSO4的Ksp大小 | 向澄清石灰水中滴入0.1 mol·L-1Na2CO3溶液至不再有沉淀产生,再滴加0.1 mol·L-1Na2SO4溶液 |
A.AB.BC.CD.D
【答案】A
【解析】
A、向FeCl3稀溶液中依次加入KI溶液、淀粉,溶液会变蓝色,说明发生反应:2Fe3++2I-=I2+ 2Fe2+,由上述方程式可判断还原性I->Fe2+,故A 正确;
B、探究HPO42-在水溶液中的电离程度与水解程度的相对大小,应该测定0.1 mol·L-1Na2HPO4溶液的pH,若显碱性,则水解程度更大;若显酸性,则电离程度更大,故B错误;
C、5.1 g邻苯二甲酸氢钾的物质的量为![]() =0.025mol,而要配置500 mL0.1 mol·L-1邻苯二甲酸氢钾溶液需要的苯二甲酸氢钾的物质的量为0.05mol,故C错误。
=0.025mol,而要配置500 mL0.1 mol·L-1邻苯二甲酸氢钾溶液需要的苯二甲酸氢钾的物质的量为0.05mol,故C错误。
D、表达式相同的溶度积,溶度积常数大的物质能转化为溶度积常数小的物质,硫酸钙、碳酸钙都是白色沉淀,所以没有明显现象,且Ksp(CaCO3)<Ksp(CaSO4),故D错误。
答案选A。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.稀硫酸与NaOH溶液反应:2H++2OH-=2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH) 2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH) 3(胶体)+3H+
Fe(OH) 3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制取少量的NOSO4H,并检验产品纯度。已知:NOSO4H遇水水解,但溶于浓硫酸而不分解。

(1)利用装置A制取SO2,下列最适宜的试剂是_____(填下列字母编号)
A.Na2SO3固体和20%硝酸 B.Na2SO3固体和20%硫酸
C.Na2SO3固体和70%硫酸 D.Na2SO3固体和18.4mol/L硫酸
(2)装置B中浓HNO3和SO2在浓H2SO4作用下反应制得NOSO4H。
①为了控制通入SO2的速率,可以采取的措施是_______。
②该反应必须维持体系温度不低于20℃。若温度过高,产率降低的可能原因是____。
③开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因可能是______。
(3)在实验装置存在可能导致NOSO4H产量降低的缺陷是______。
(4)测定NOSO4H的纯度
准确称取1.337 g产品加入250 mL碘量瓶中,加入0.1000mol/L、60.00 mL的KMnO4标准溶液和10 mL 25%H2SO4溶液,然后摇匀。用0.2500 mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+___C2O42-+______=___Mn2++____+__H2O
②亚硝酰硫酸的纯度=___%(计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原
反应的关系”可用如图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:___CuO+____NH4Cl ![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______(填元素名称),氧化剂是________(填化学式)。
③反应中若产生0.2mol的气体,则有________mol的电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将ag某物质在足量氧气中充分燃烧再将气体生成物通入足量的Na2O2充分反应,固体增重为bg,若a<b,则该物质可能是( )
A. H2B. COC. 乙酸(CH3COOH)D. 甲烷(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):
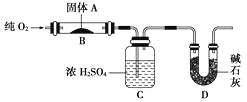
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
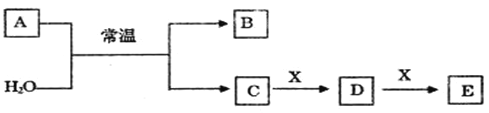
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:____________________________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为_____________________________________。
②X可能为__________________(填代号)。
A.NaHCO3b.Na2CO3 C.Na2SO3 D.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①A与H2O反应的氧化产物为_____________。
②若X为非金属单质,通常为黑色粉末,写出E的化学式______________。
③若X为一种造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为______(填代号)。
A.盐酸 B.BaCl2溶液 C.NaOH溶液 D.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。
①A与H2O反应的化学反应方程式为__________________________________。
②检验溶液D中还可能存在Fe2+的方法是_________________________________(注明试剂、现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共5种物质:H2S+HNO3→S+NO+H2O;下列说法中正确的是( )
A.该反应中的还原产物是S
B.若反应过程中转移了0.3 mol 电子,则氧化产物的质量9.6g
C.氧化剂与还原剂的物质的量之比为2∶3
D.反应后溶液的酸性明显增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com