
【题目】有关过氧化钠与水反应,下列说法错误的是( )
A.产生的气体可以使带火星的木条复燃
B.过氧化钠是氧化剂,水是还原剂
C.反应后的溶液中滴加酚酞后溶液将变红
D.该反应是放热反应
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是研究有机物结构的有力手段之一,例如乙醛的结构简式为CH3-CHO,在核磁共振氢谱中有两个峰,其峰面积之比为3:1。
(1)结构式为![]() 的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
(2)某含氧有机物,其质谱图中最大质荷比为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,核磁共振氢谱中只有一个吸收峰,则该有机物的相对分子质量为___________,其结构简式是 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性I->Fe2+>I2,在水溶液中I2可被Cl2氧化为IO![]() 。向含溶质a mol的FeI2溶液中通入b mol Cl2,充分反应(不考虑单质与水的反应)。下列说法不正确的是( )
。向含溶质a mol的FeI2溶液中通入b mol Cl2,充分反应(不考虑单质与水的反应)。下列说法不正确的是( )
A. 当a=2b时,反应后的离子浓度之比c(Fe2+)∶c(I-)∶c(Cl-)=1∶1∶1
B. 当3a=2b时,发生的离子反应:2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
C. 当13a=2b时,发生的离子反应为2Fe2++4I-+13Cl2+12H2O===4IO![]() +26Cl-+2Fe3++24H+
+26Cl-+2Fe3++24H+
D. 若反应后溶液中I2与IO![]() 的物质的量之比为1∶1,则反应中转移电子3.5b mol
的物质的量之比为1∶1,则反应中转移电子3.5b mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有6种短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
W | 周期表中原子半径最小的元素 |
U | 地壳中含量最多的金属元素 |
R | 单质为空气的主要成分 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有__个电子;元素X的一种核素可测定文物年代,这种核素的符号是___。
(2)用电子式表示:
①气态化合物XR2_______;
②元素W、R形成的10电子分子的形成过程_____________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应_____;
②元素U的单质与NaOH溶液反应_______。
(4)元素Z与元素T相比,非金属性较强的是___,下列表述中能证明这一事实的是___(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是____(用分子式表示),理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究实验室制氯气过程中反应物与生成氯气之间量的关系,设计了如下图所示的装置。

(1)装置A的名称是_____________________。
(2)该实验装置检查气密性的方法是________________________________。
(3)如果将过量二氧化锰与20mL 12mol/L的盐酸混合加热,充分反应后收集到的氯气少于0.06mol,其可能原因有__________
a.加热使浓盐酸挥发出大量HCl b.盐酸变稀后不发生该反应
c.烧瓶中残留有氯气 d.装置B中液面高于A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境,就是保护自己。下列环境问题与产生的主要原因不相符的是( )
A.“光化学烟雾”主要是由NO2等引起的
B.“酸雨”主要是由空气中CO2浓度增大引起的
C.“白色污染”主要是由聚乙烯塑料等引起的
D.“温室效应”主要是由空气中CO2浓度增大引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,工业大规模生产前,实验室先按如下流程进行模拟制备少量Mg(ClO3)2·6H2O:
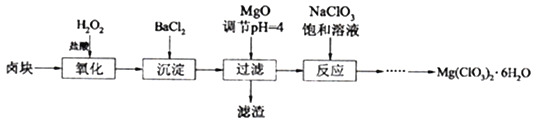
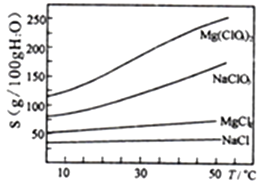
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②几种化合物的溶解度(S)随温度(T)变化曲线如右图。
(1)卤块中加H2O2的目的是________________,写出该反应的离子方程式__________________。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?_________________。
(3)常温下,加MgO调节pH=4后溶液中c(Fe3+)=___________(已知Ksp[Fe(OH)3=4×10-38],过滤所得滤渣的主要成分有______________。
(4)加入NaClO3饱和溶液公有NaCl晶体析出,写出该反应的化学方程式:___________,请利用该反应,结合上图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发结晶;③___________;④冷却结晶;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:

(1)非金属性最强的是______(填元素符号),化学性质最不活泼的是_____(填元素符号)。
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________。(填化学式)
(4)表中能形成两性氢氧化物的元素是_________(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:___________________,_________________________。
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.100 mol·L-1盐酸分别滴定20.00 mL 0.100 mol·L-1的氨水和20.00 mL 0.100 mol·L-1NaOH溶液,两溶液的pH与所加盐酸体积(V)的关系如图所示。下列说法正确的是 ( )

A. Kb(NH3·H2O)的数量级为10—4
B. 10 < a < 20
C. P点溶液中:c(NH4+)>c(Cl一)
D. 水的电离程度:M > N > P
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com