
【题目】某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是
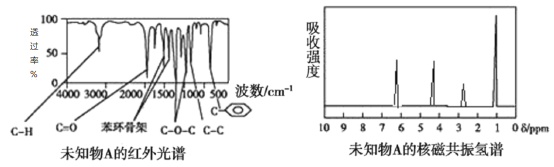
A.由红外光谱可知,该有机物中含有C—H键、C=O键、![]() 等
等
B.由核磁共振氢谱可知,该有机物分子中有4种不同化学环境的氢原子
C.若A的化学式为C8H8O2,则其结构简式可能为
D.仅由以上信息无法得知其分子中的氢原子总数
科目:高中化学 来源: 题型:
【题目】美国马丁·卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖。他们模拟出了1, 6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示。下列说法正确的是 ( )
![]()
A. 该有机物属于芳香烃,与苯互为同系物
B. 该有机物的分子式为C18H18
C. 1 mol该有机物在常温下最多能与9 mol Br2发生加成反应
D. 该有机物可以发生氧化反应、取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O)D.4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是( )

A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:![]()
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2 L氟化氢所含分子数为0.5NA
B.1 L 1 mol·L-1的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA
C.在0 ℃时,22.4 L氢气中含有2NA个氢原子
D.1 mol乙烷分子中共价键总数为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。已知:①CO(g)+
CH3OH(g)。已知:①CO(g)+![]() O2(g)=CO2(g) △H1=-283.0kJ/mol
O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+![]() O2(g)=H2O(g) △H2=-241.8kJ/mol
O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g)![]() CH3OH(g)的反应热△H4=________________。
CH3OH(g)的反应热△H4=________________。
(2)若在绝热、恒容的密闭容器中充入1mol CO、2mol H2,发生CO(g)+2H2(g)![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。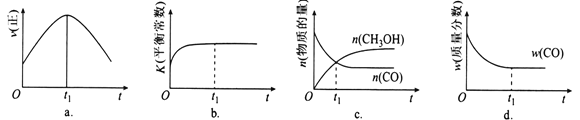
(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,则5min内用H2表示的反应速率为v(H2)=__________。T1℃时,CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=______________。
CH3OH(g)的平衡常数K=______________。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_____________________。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法错误的是
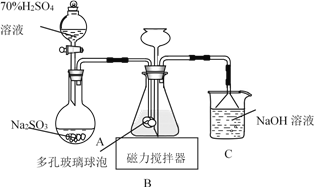
A. 制备保险粉的离子方程式为HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使SO2能被充分吸收
D. 为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中残留的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有机物在化学反应中断键的位置,可以准确分析产物结构并判断反应类型。有机物A中只含有C、H、O三种元素,它的球棍模型如下:

(1)A的分子式为_______,写出碳原子数比A少的A的一种同系物的结构简式____。
(2)工业中采取烯烃水化法制取A,该烯烃的结构简式为_______。
(3)A与乙酸、浓硫酸共热反应,断裂的化学键为_______(填序号,下同),该反应的有机产物中官能团的名称为_______。
(4)在Cu催化和加热条件下,A与O2反应断裂①、③两处共价键,写出该反应的化学方程式_______。
(5)A与亚硫酞氯(SOCl2)在一定条件下反应生成一种一氯代烃,A 断裂的共价键为_______,该反应类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(改编)在稀硫酸与锌反应制取氢气的实验中,探究加入硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0~4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336mL)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是

A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a、c两点对应的氢气生成速率相等
C.b点对应的反应速率为v(H2SO4) = 1.0×10-3 mol·L-1·s-1
D.d点没有构成原电池,反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com