
【题目】某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO![]() 、⑥SO
、⑥SO![]() 中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
(1) | 用pH试纸检验 | 溶液的pH大于7 |
(2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
(3) | 向(2)所得的水溶液中加入Ba(NO3)2溶液和稀硝酸 | 有白色沉淀产生 |
(4) | 过滤,向滤液中加入AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
下列结论正确的是( )
A. 不能确定的离子是① B. 不能确定的离子是③⑤
C. 肯定含有的离子是①④⑤ D. 肯定没有的离子是②⑤
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH增大
C. 滴加新制氯水,平衡向左移动,溶液pH减小
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是_________(写化学式)。
(2)写出并配平该反应的化学方程式:_________;
(3)发生还原反应的物质是_________,反应中2mol的氧化剂能_________(填“失去”或“得到”)_________mol电子.
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A. ①中水银“积变又还成丹砂”说明水银发生了还原反应
B. ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu
C. 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D. 水银能跟曾青发生置换反应生成单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,
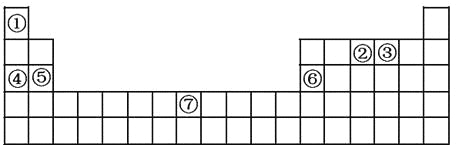
回答下列问题:
(1)画出③元素的原子结构示意图 ;在④⑤⑥三种元素中,原子半径最大的是 (用元素符号表示);⑦元素在周期表中的位置是 。
(2)④的单质在③的单质中燃烧生成甲,甲中化学键的类型为 。
(3)写出⑥的最高价氧化物与④的最高价氧化物对应水化物反应的离子方程式 。
(4)②的最简单气态氢化物与其最高价含氧酸可发生化合反应生成乙,用离子方程式表示乙的水溶液显酸性的原因 。
(5)丙是⑤的最高价氧化物对应的水化物,难溶于水。在298K时,丙的Ksp=5.6×10—12,则pH=13.0的丙的饱和溶液中,⑤离子的物质的量浓度为 。
(6)向含元素⑦的某硫酸盐(丁)溶液中加入足量的浓NaOH溶液,生成无色有刺激性气味的气体,同时产生白色沉淀,很快变成灰绿色,最后变成红褐色。写出丁的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于过氧化钠的叙述中,正确的是( )
A. 将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B. 1 mol Na2O2与H2O完全反应,转移2 mol电子
C. 充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D. a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化工生产的叙述中,符合目前工业生产实际的是( )
A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品
B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率
D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2![]() CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
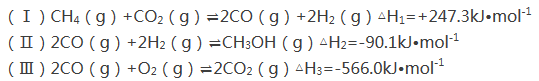
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向容积为4 L的容器通人6 mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为![]() ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反应”或“逆反应”)方向移动。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com