
| A、该溶液的pH值可能为1 |
| B、水的电离受到促进 |
| C、水的离子积将变小 |
| D、该溶液的pH值一定为13 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
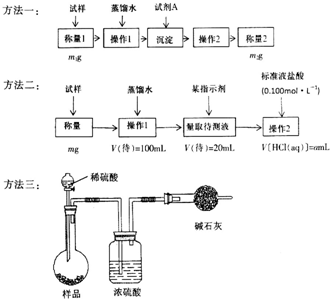 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将乙酸和乙醇混合加热制乙酸乙酯 |
| B、苯和浓溴水反应制溴苯 |
| C、CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D、用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、铁为阳极,H2SO4为电解液 |
| B、铁为阴极,浓NaOH为电解液 |
| C、阳极发生的电极反应为Fe+8OH--6e-═4H2O+FeO42- |
| D、铁失去3 mol电子可以在阴极得到33.6 L氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
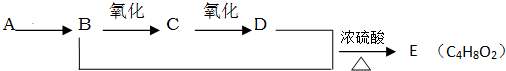
| 氧化 |
| 氧化 |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B、已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4 |
| C、常温下,将pH=8的醋酸钠溶液稀释,溶液中所有离子浓度都减小 |
| D、反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
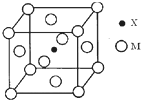 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.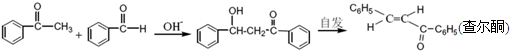
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com