
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| T/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 0.75��1.5 |
| 1��1.2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��δϴ���ձ��Ͳ����� |
| B��ת����Һǰ��Һδ��ȴ������ |
| C������ƿδ���� |
| D������ʱ����Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
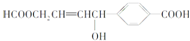
| A��1 mol���л��������3 mol Na������Ӧ |
| B��1 mol���л��������3 mol NaOH������Ӧ |
| C��1 mol���л��������6 mol H2�����ӳɷ�Ӧ |
| D��1 mol���л���ֱ�������Na��NaHCO3��Ӧ����������������ͬ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
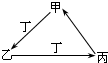 �ס��ҡ����������������У��ס��ҡ�����������ͬ��ij��Ԫ�أ�����֮���������ͼת����ϵ�������й����ʵ��ƶ���ȷ���ǣ�������
�ס��ҡ����������������У��ס��ҡ�����������ͬ��ij��Ԫ�أ�����֮���������ͼת����ϵ�������й����ʵ��ƶ���ȷ���ǣ�������| A������Ϊ��̿��������O2 |
| B������ΪFe��������Cl2 |
| C������ΪAlCl3��������NH3 |
| D������ΪNaHCO3��������HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A�������£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH������H2SO3 |
| B��������Һ�У�ˮ�ĵ���̶�������NaClO |
| C������ˮ�м�������NaHCO3����������ˮ�д������Ũ�� |
| D��NaHSO3��Һ������Ũ�ȴ�С˳��Ϊ��c��Na+����c��H+����c��HSO3-����c��SO32-����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Һ��pHֵ����Ϊ1 |
| B��ˮ�ĵ����ܵ��ٽ� |
| C��ˮ�����ӻ�����С |
| D������Һ��pHֵһ��Ϊ13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com