
����Ŀ��������Ԫ��X��Y��Z��W��R��T ��ԭ�������������� X �������������������������ȣ� X�� Wλ��ͬ�塣Y��Z�ļ۵�����֮�͵���R��T������������֮�ͣ�������Ԫ�����������Z2TY3��ZRY2���ں��������εĻ����Һ�еμ����ᣬ������ɫ���������ʵ�������������Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. �����ӵİ뾶��r��Y����r��Z����r��W��
B. ��̬�⻯������ȶ��ԣ� T > Y
C. ��ҵ�ϵ��R���Ȼ���ұ������R
D. X����������ȿ���ǿ�ᷴӦ���ֿ���ǿ�Ӧ
���𰸡�D
��������
����ԭ�ӽṹ��Ԫ�������ڱ��е�λ�ã���϶����ڡ�ԭ�����������γ��εĻ�ѧʽ�ȣ��ƶ�Ԫ�أ���������ͼ�ش����⡣
������������������ȵ�Ԫ����Be��Ar������Xֻ��Ϊ�루Be������Xͬ�����WΪþ��Mg�������λ�ѧʽZ2TY3��ZRY2��֪��YΪ����O������������ᷴӦ��ͼ��RΪ����Al������ԭ��������������������ZԪ��ֻ�����ƣ�Na�����־�Y��Z��R��T �ļ۵��ӹ�ϵ��֪TΪ�裨Si����
A�O2����Na+��Mg2+��������Ų���ͬ���˵�ɴ�ģ������Ӱ뾶С�������Ӱ뾶��r��Y��>r��Z��>r��W����A�����
B���Ԫ�������ڱ��е�λ�ã�֪�ǽ�����Si<O������̬�⻯������ȶ��ԣ� T < Y��B�����
C���ҵ�ϵ�����ڵ�������ұ�����������Ȼ���Ϊ���ۻ��������ʱ���ܱ���⣬C�����
D��ݶԽ��߷�����������������������ƣ���������������ȿ���ǿ�ᷴӦ���ֿ���ǿ�Ӧ��D����ȷ��
����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء�����˵����������
A.����Ǧ���ص�Ǧ��ͷ�������������
B.�������濾������һ�����ܵ�Fe3O4��������ʴ������
C.�����к���̼������ʴ�����ȴ�����
D.�����ƹ�̫���ܡ����ܡ������ܼ�ˮ�ܵȵ�ʹ�ã����ٻ�ʯȼ�ϵ�ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����48g̼����ȫȼ�����������У�CO��CO2��ռ![]() �������C��s��+
�������C��s��+![]() O2��g���TCO��g����H=��110.5kJmol��1��CO��g��+
O2��g���TCO��g����H=��110.5kJmol��1��CO��g��+![]() O2��g���TCO2��g����H=��283kJmol��1������Щ̼��ȫȼ����ȣ���ʧ��������
O2��g���TCO2��g����H=��283kJmol��1������Щ̼��ȫȼ����ȣ���ʧ��������
A. 172.5 kJB. 1 149 kJC. 283 kJD. 566 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������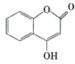 �������Ʊ�����Ѫҩ��ͨ������·�ߺϳɣ�
�������Ʊ�����Ѫҩ��ͨ������·�ߺϳɣ�

��1��B��C�ķ�Ӧ������__________��
��2��д��F����Na0H��Һ����ʱ��Ӧ�Ļ�ѧ����ʽ__________��
��3�����й���G��˵����ȷ����__________������ĸ����
a.�����嵥�ʷ�Ӧ b.��������Ʒ�Ӧ
c.1molG����ܺ�3mol������Ӧ d.����ʽ��C9H6O3
��4��E��ͬ���칹��ܶ࣬��E��������������Ĺ�__________�֡�
a.�������������Ȼ�����Һ��ɫ�� b.������������ȡ������ c.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Է�����ָ�ڷ��ӽṹ![]() �У��� a��b��x��y Ϊ�˴˻�����ͬ��ԭ�ӻ�ԭ����ʱ���ƴ˷���Ϊ���Է��ӣ�����̼ԭ��Ϊ����̼ԭ�ӣ����з�����ָ����̼ԭ�ӣ���*��ǣ�����������̼ԭ�ӵ��ǣ� ��
�У��� a��b��x��y Ϊ�˴˻�����ͬ��ԭ�ӻ�ԭ����ʱ���ƴ˷���Ϊ���Է��ӣ�����̼ԭ��Ϊ����̼ԭ�ӣ����з�����ָ����̼ԭ�ӣ���*��ǣ�����������̼ԭ�ӵ��ǣ� ��
A. ľ�Ǵ� B. ������
B. ������
C. ������ D. ����ȩ
D. ����ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������գ�
��1����Fe(NO3)3��Һ�м���Na2SO3��Һ,��Һ�����ػ�ɫ��Ϊdz��ɫ����һ���ֱ�Ϊ�ػ�ɫ����Һ�ȱ�Ϊdz��ɫ��ԭ����_________________�������ֱ�����ֱ�Ϊ�ػ�ɫ�����ӷ���ʽ��_____________________��
��2�������꿪���ļ״�ȼ�ϵ�ز��ò����缫����������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ����ʾ��ͼ���£�

Pt(a)�缫�ǵ�ص�________�����缫��ӦʽΪ________________________��Pt(b)�缫����________��Ӧ(���������ԭ��)���缫��ӦʽΪ_________________________
��3����֪Ǧ���صĹ���ԭ��ΪPb��PbO2��2H2SO4![]() 2PbSO4��2H2O��������ͼװ�ý��е��(���Һ����)����õ�Ǧ������ת��0.4 mol����ʱ���缫����������11.2 g����ش��������⡣
2PbSO4��2H2O��������ͼװ�ý��е��(���Һ����)����õ�Ǧ������ת��0.4 mol����ʱ���缫����������11.2 g����ش��������⡣

��A��Ǧ���ص�________����Ǧ����������ӦʽΪ_____________________��
��Ag�缫�ĵ缫��Ӧʽ��__________________________��
��Cu�缫�ĵ缫��Ӧʽ��________________________________��
CuSO4��Һ��Ũ��________(���С���������䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɻ���Ӧ���л��ϳ��о�����ҪӦ�ã�ij��״������G�ĺϳɹ������£�

��1��A��BΪ�ӳɷ�Ӧ����B�Ľṹ��ʽ��________��B��C�ķ�Ӧ������________��
��2��G�к��еĹ�����������___________��
��3��D��E�Ļ�ѧ����ʽ��__________________________��Ӧ����Ϊ��__________��
��4��H��F��ͬ���칹�壬�������нṹ�������ٺ˴Ź������׳��������շ������1�����շ壻�ڴ��ڼ�������CH3O������H�Ľṹ��ʽ��_____________��
��5����Cͨ���Ӿ۷�Ӧ�ϳɵĸ߷��ӻ�����M�Ļ�ѧ����ʽΪ_______________________��
��6������˵����ȷ����______��
a��A�ܺ�HCl��Ӧ�õ�������ϩ�ĵ��� b��D��F�о���������
c��1mol G��ȫȼ������8mol H2O d��F�ܷ����ӳɷ�Ӧ��ȡ����Ӧ��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Բ����ƿ�м���1 molC2H5OH�ͺ�1molHBr�������ᣬ��Һ�з�����Ӧ��C2H5OH+HBr![]() C2H5Br+H2O����ַ�Ӧ��ﵽƽ�⡣��֪��ѹ�£�C2H5Br��C2H5OH�ķе�ֱ�Ϊ38.4���78.5�档�����й������������
C2H5Br+H2O����ַ�Ӧ��ﵽƽ�⡣��֪��ѹ�£�C2H5Br��C2H5OH�ķе�ֱ�Ϊ38.4���78.5�档�����й������������
A. ����NaOH���������Ҵ������ʵ���
B. ����HBrŨ�ȣ�����������C2H5Br
C. ����Ӧ��������2 mol�������ַ�Ӧ��ƽ��ת����֮�Ȳ���
D. ����ʼ�¶������60�棬�����̷�Ӧ�ﵽƽ���ʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������м���A��B��C�������壬����һ���¶ȣ���t1��t4(s) ʱ�̲�ø����ʵ�Ũ�����±������н�����ȷ����
�ⶨʱ��/s | t1 | t2 | t3 | t4 |
c(A) / (mol��L��1) | 6 | 3 | 2 | 2 |
c(B) / (mol��L��1) | 5 | 3.5 | 3 | 3 |
c(C) / (mol��L��1) | 1 | 2.5 | 3 | 3 |
A. ��t3ʱ�̷�Ӧ�Ѿ�ֹͣ
B. t3��t4�������淴Ӧ���ʲ����
C. �������з����ķ�ӦΪA + B![]() C
C
D. ��t2��t3��A��ƽ����Ӧ����Ϊ![]() mol��L-1��s-1
mol��L-1��s-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com