
【题目】完成下列填空:
(1)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(2)近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

Pt(a)电极是电池的________极,电极反应式为________________________;Pt(b)电极发生________反应(填“氧化”或“还原”),电极反应式为_________________________
(3)已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

①A是铅蓄电池的________极,铅蓄电池正极反应式为_____________________,
②Ag电极的电极反应式是__________________________,
③Cu电极的电极反应式是________________________________,
CuSO4溶液的浓度________(填“减小”“增大”或“不变”)。
【答案】Fe3+被还原为Fe2+ 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O负2CH3OH+2H2O-12e-=2CO2↑+12H+还原3O2+12H++12e-=6H2O负PbO2+4H++SO42-+2e-═PbSO4+2H2O2H++2e-=H2↑Cu-2e-=Cu2+不变
【解析】
(1)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,原因是Fe3+与SO32-发生氧化还原反应生成Fe2+和SO42-,反应的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,反应后溶液呈酸性,则在酸性条件下NO3-与Fe2+反应生成Fe3+,过一会又变为棕黄色,反应的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:Fe3+被还原为Fe2+;3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(2)甲醇燃料电池的负极上是燃料失电子的氧化反应:2CH3OH+2H2O-12e-=2CO2↑+12H+,Pt(b)电极为正极,发生还原反应,电极反应式为:3O2+12H++12e-═6H2O,故答案为:负;2CH3OH+2H2O-12e-=2CO2↑+12H+;还原;3O2+12H++12e-═6H2O;
(3)①当铅蓄电池中转移0.4mol电子时铁电极的质量减小11.2g,说明铁作阳极,银作阴极,阴极连接原电池负极,所以A是负极,B是正极,正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O,故答案为:负;PbO2+4H++SO42-+2e-═PbSO4+2H2O;
②银作阴极,发生还原反应,溶液中的氢离子在银上得到电子生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
③Cu为阳极,发生氧化反应,铜为活性电极,电极反应式为Cu-2e-=Cu2+,该装置是电镀池,电解质溶液中铜离子浓度不变,故答案为:Cu-2e-=Cu2+;不变。


科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
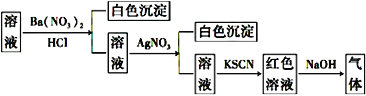
A. 原溶液中一定含有SO42-B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl-D. 原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修有机化学基础]
化合物F是合成抗心律失常药—多非利特的中间体,以苯为原料合成F的路线如下:

已知:①CH3CH=CH2![]() CH3CHBrCH3 ②CH3CH=CH2
CH3CHBrCH3 ②CH3CH=CH2![]() CH3CH2CH2Br
CH3CH2CH2Br
试回答下列问题
(1)苯→A转化的反应类型是 。
(2)化合物C→D转化的反应条件通常是 ,化合物D (填“存在”、“不存在”)顺反异构,已知化合物C的核磁共振氢谱显示有四种峰,且峰的面积比为2︰2︰1︰3,则C的结构简式为 。
(3)写出E→F转化的化学方程式 。
(4)化合B的同分异构体有多种,满足以下条件的同分异构体共有 种。
①属于芳香族化合物
②分子结构中没有甲基,但有氨基
③能发生银镜反应和水解反应,并且与NaOH反应的物质的量之比为1︰2
(5)苯乙酮( )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线 。
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
A.Cu能与浓硝酸反应,但不能与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,高压放电时可反应
D.块状石灰石与盐酸反应比粉末状石灰石与盐酸反应慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、R、T 的原子序数依次增大, X 的最外层电子数与次外层电子数相等, X、 W位于同族。Y和Z的价电子数之和等于R和T的最外层电子数之和,这四种元素组成两种盐Z2TY3和ZRY2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是

A. 简单离子的半径:r(Y)<r(Z)<r(W)
B. 气态氢化物的热稳定性: T > Y
C. 工业上电解R的氯化物冶炼单质R
D. X的氢氧化物既可与强酸反应,又可与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不正确的是
A. 明矾可用作净水剂
B. 热的纯碱溶液可以去除物品表面的油污
C. 氢氧化钠可用来治疗胃酸过多
D. 过氧化钠可用作潜艇里氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1.0mol/L 盐酸滴入20mL 10mol/L氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示。下列有关说法正确的是

A. a点,c(NH4+)=c(OH-)
B. b点,c(NH4+)>c(Cl-)>c(NH3·H2O)
C. c点,pH=7
D. d点,c(NH4+)+c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化俚(Li3N)是一种金属化合物,常用作储氢材料,某化学兴趣小组设计制备氮化锂并测定其组成的实验如下(已知:Li3N易水解)。

请回答下列问题:
(1)Li3N水解的化学方程式为__________________。
(2)实验时首先点燃A处酒精灯。写出装置A中发生反应的化学方程式______________。
(3))装置D的作用是_______________。
(4)请用化学方法确定氮化锂中含有未反应的锂,写出实验操作及现象______________。
(5)测定氮化锂的纯度。
假设锂粉只与氮气反应。称取6.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入200.00mL1.00mol/L盐酸中,充分反应后,将所得溶液稀释至500.00mL;取25.00mL稀释后的溶液注入锥形瓶中,加入几滴酚酞,用0.10mol/LNaOH标准溶液滴定过量的盐酸。
①判断滴定终点的现象是___________。
②滴定起始和终点的液面位置如图,则产品的纯度为___________。

③若漓定前平视读数,滴定后仰视读数,则测定结果____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe + H2SO4 =FeSO4 + H2↑的能量变化如图所示,请回答下列问题:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是____(填字母,双选)
A.改铁片为铁粉
B.改稀H2SO4为98%的浓H2SO4
C.升高温度
D.将2.4 mol·L―1的稀硫酸改为4.8 mol·L-1稀盐酸
(3)若将上述反应设计成原电池,则铜极上发生的电极反应为____,外电路中电子由___极(填“正”或“负”,下同)向____极移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com