
【题目】100 g炭粉燃烧所得气体中,CO占![]() 体积、CO2占
体积、CO2占![]() 体积,且
体积,且
C(s)+![]() O2(g)=CO(g) ΔH=-110.35 kJ·mol-1
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-392.92 kJ·mol-1
与这些炭完全燃烧相比较,损失的热量是________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
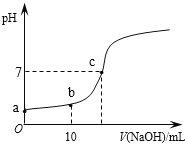
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
【1】为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素![]() Md的质量数为( )
Md的质量数为( )
A.101B.157C.258D.359
【2】Mg和Si都属于元素周期表第3周期元素,它们原子结构中相同的是( )
A.质子数B.电子层数C.核外电子数D.最外层电子数
【3】判断Cl的非金属性比S的强,可依据的事实是( )
A.HCl的热稳定性比H2S的强B.氯气能溶于水,硫难溶于水
C.常温下,氯单质呈气态,硫单质呈固态D.AgCl是白色固体,Ag2S是黑色固体
【4】锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )
A.最高化合价为+2B.原子半径比钠的大
C.单质与水的反应比钠更剧烈D.最高价氧化物对应的水化物碱性比钠的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺肿大,因此补充人体所需的元素时也要适可而止。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:__。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系是__。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上不能用电解熔融氯化铝的方法获取铝单质,这是因为__。
(4)F与I是同一主族的元素,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为__、__,BeF2分子的立体构型是___,H2O分子的立体构型是__。
(5)I2晶体的晶胞结构如图所示,该晶胞中含有__个I2分子,设该晶胞的晶胞参数为acm,则I2的密度是__g·cm-3。
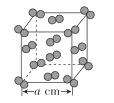
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列①②对应的试剂(或条件)不能完成实验目的的是( )
![]()
实验目的 | 试剂(条件) | |
A | 温度对Na2S2O3溶液与H2SO4溶液反应速率的影响 | ①热水浴②冷水浴 |
B | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇②煤油 |
C | 用硝酸酸化的AgNO3溶液检验自来水中能否蒸馏除去Cl- | ①自来水②蒸馏水 |
D | 催化剂对H2O2分解速率的影响 | ①0.1mol/LFeCl3 ②0.2mol/LFeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol·L-1 H2SO4洗涤Fe粉,其目的是____,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入____(写化学式)。
(2)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式____。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是____。
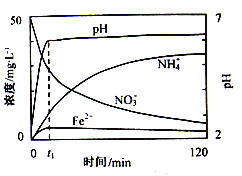
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:____;
假设三:____;
(4)请你设计实验验证上述假设一,补充实验步骤及结论:(已知:溶液中的NO3-浓度可用离子色谱仪测定)____、____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________,基态S原子电子占据最高能级的电子云轮廓图为____________形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图(a)为S2的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____________。
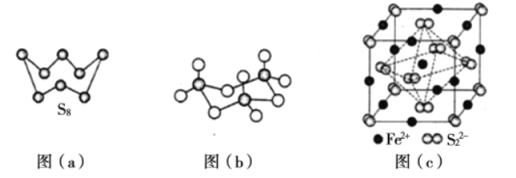
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有____________种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为____________。
(5) FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm, FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g·cm-3;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为____________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com