
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol·L-1 H2SO4洗涤Fe粉,其目的是____,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入____(写化学式)。
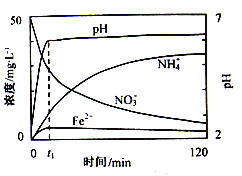
(2)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式____。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是____。
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:____;
假设三:____;
(4)请你设计实验验证上述假设一,补充实验步骤及结论:(已知:溶液中的NO3-浓度可用离子色谱仪测定)____、____。

【答案】除去铁粉表面的氧化物等杂质 N2 4Fe+10H++NO3-=4Fe2++NH4++3H2O 生成的Fe2+水解(或和溶液中OH-的结合) 温度 铁粉颗粒大小 pH各不相同,并通入氮气 用离子色谱仪测定相同反应时间时各溶液中NO3-的浓度,若pH不同KNO3溶液中,测出的NO3-浓度不同,表明pH对脱氮速率有影响,否则无影响
【解析】
本题是模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)①铁表面的氧化物主要是氧化铁,因此H2SO4可以除去Fe粉表面的氧化物是发生反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;故答案为:除去铁粉表面的氧化物等杂质;
②氧气具有氧化性,而空气中含有大量的氧气,所以为防止空气中的O2对脱氮的影响,可向KNO3溶液中通入N2,排出O2;故答案为:N2;
(2)根据图中信息可判断,t1时刻前溶液中离子浓度减小的有:H+、NO3-、增大的有Fe2+、NH4+ ,t1时刻前反应的离子方程式为:4Fe+10H++NO3-=4Fe2++NH4++3H2O ,故
t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是发生了水解反应,溶液pH增大,促进水解,故答案为4Fe+10H++NO3-=4Fe2++NH4++3H2O;生成的Fe2+水解(或和溶液中OH-的结合);
(3)影响脱氮速率的因素除了溶液的pH外,还可能是温度、固体与溶液的接触面积等,故答案为:温度;铁粉颗粒大小;
(4)要验证溶液的pH影响脱氮速率,需要设计对照实验,其他条件相同,而pH不同,并通入氮气, 再分别向溶液中分别加入足量等质量的同种铁粉,根据已知用离子色谱仪测定相同反应时间时各溶液中NO3-的浓度,故答案为:pH各不相同,并通入氮气;用离子色谱仪测定相同反应时间时各溶液中NO3-的浓度,若pH不同KNO3溶液中,测出的NO3-浓度不同,表明pH对脱氮速率有影响,否则无影响。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如图所示。该可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德罗常数的值。下列说法错误的是( )
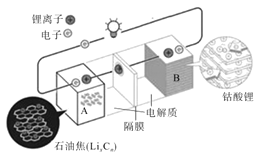
A.该电池用于电动汽车可有效减少光化学烟雾污染
B.充电时,正极反应为LiCoO2-xe-=Li(1-x)CoO2+xLi+
C.放电时,Li+由A极移向B极
D.若初始两电极质量相等,当转移2NA个电子时,两电极质量差为14g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示的装置对能量变化情况进行研究。当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升。不符合要求的X、Y可能是( )
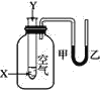
A.X是水,Y是浓硫酸
B.X是盐酸,Y是氢氧化钠溶液
C.X是硝酸铵固体,Y是水
D.X是铝粉,Y是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 g炭粉燃烧所得气体中,CO占![]() 体积、CO2占
体积、CO2占![]() 体积,且
体积,且
C(s)+![]() O2(g)=CO(g) ΔH=-110.35 kJ·mol-1
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-392.92 kJ·mol-1
与这些炭完全燃烧相比较,损失的热量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1000mol/L的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol/LNaOH溶液、0.1000mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示,下列说法不正确的是( )
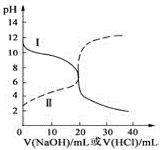
A.由滴定曲线,25℃时Ka(CH3COOH)=Kb(NH3·H2O)=10-5
B.当NaOH溶液和盐酸滴加到20.00mL时,曲线Ⅰ和Ⅱ刚好出现交点
C.曲线Ⅱ:滴加溶液到10.00mL时,溶液中c(CH3COO-)+c(OH-)>c(H+)
D.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×![]()
![]() ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.将1 mol ![]() 转化为
转化为![]() 胶体,
胶体,![]() 胶粒数小于6.02×
胶粒数小于6.02×![]()
B.标准状况下,22.4 L![]() 中含有溴原子数约为2×6.02×
中含有溴原子数约为2×6.02×![]()
C.常温下,9.2 g ![]() 含有的分子数小于0.2×6.02×
含有的分子数小于0.2×6.02×![]()
D.25℃时,pH=12的![]() 溶液1 L所含
溶液1 L所含![]() 数约为6.02×
数约为6.02×![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008奥运吉祥物福娃,其外材为纯羊毛线,内充物为无毒的聚酯纤维(如图)。下列说法正确的是

A. 羊毛与聚酯纤维的化学成分相同
B. 该聚酯纤维的单体为对苯二甲酸和乙醇
C. 聚酯纤维和羊毛一定条件下均能水解
D. 聚酯纤维属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,下列说法正确的是
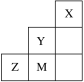
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.Z和M的最高价含氧酸中非羟基氧原子数分别为2和3
D.Z元素基态原子的轨道表示式为:![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
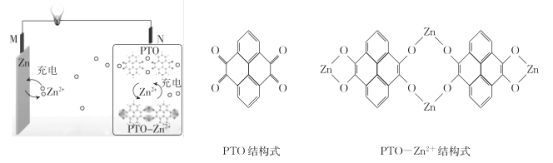
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com