
【题目】某学生用如图所示的装置对能量变化情况进行研究。当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升。不符合要求的X、Y可能是( )
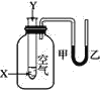
A.X是水,Y是浓硫酸
B.X是盐酸,Y是氢氧化钠溶液
C.X是硝酸铵固体,Y是水
D.X是铝粉,Y是稀硫酸
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol/L的盐酸时,下列说法正确的是( )
A.AgCl沉淀溶解平衡向溶解方向移动B.AgCl的Ksp增大
C.溶液中c(Cl-)增大D.溶液中c(Ag+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.氢氧化铁溶于盐酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.用惰性电极电解饱和食盐水:2Cl- + 2H2O![]() 2OH- + H2↑+ Cl2↑
2OH- + H2↑+ Cl2↑
C.过氧化钠投入重水中:2Na2O2 + 2D2O = 4Na+ + O2↑+ 4OD-
D.向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
【1】为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素![]() Md的质量数为( )
Md的质量数为( )
A.101B.157C.258D.359
【2】Mg和Si都属于元素周期表第3周期元素,它们原子结构中相同的是( )
A.质子数B.电子层数C.核外电子数D.最外层电子数
【3】判断Cl的非金属性比S的强,可依据的事实是( )
A.HCl的热稳定性比H2S的强B.氯气能溶于水,硫难溶于水
C.常温下,氯单质呈气态,硫单质呈固态D.AgCl是白色固体,Ag2S是黑色固体
【4】锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )
A.最高化合价为+2B.原子半径比钠的大
C.单质与水的反应比钠更剧烈D.最高价氧化物对应的水化物碱性比钠的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新技术的开发应用,不仅有利于改善环境质量,而且能充分开发“废物”的潜在价值。
回答下列问题:
(1)用烟道气与氢气来合成甲醇涉及到如下几个反应:
①CO(g)+2H2(g)=CH3OH(g) △H=-91kJ·mol-1
②2CO2(g)=2CO(g)+O2(g) △H=+566kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
④CO2(g)+3H2(g)=CH3OH(g)+H2O(g)H=__kJ·mol-1。
(2)在容积均为2L的两个恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),有关数据如下:
CO2(g)+H2(g),有关数据如下:

①800°C时该反应的平衡常数K=__。
②容器2中x=__,n=___。
③若800℃起始时,在2L恒容密闭容器中加入CO、H2O、CO2、H2各1mol,则此时v正__v逆(填“>”“<”或“=”)。
(3)反应(NH4)2CO3+H2O+CO2![]() 2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
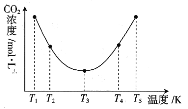
①H__0(填“>”“<”或“=”)。T1~T2区间,c(CO2)变化的原因是___。
②已知常温下NH3·H2O的电离常数K=1.8×10-5,碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,则恰好完全反应时所得的NH4HCO3溶液中c(H+)__c(OH-)(填“>”“<”或“=”)。
③在图中所示五种温度下,该反应的平衡常数最大的温度是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺肿大,因此补充人体所需的元素时也要适可而止。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:__。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系是__。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上不能用电解熔融氯化铝的方法获取铝单质,这是因为__。
(4)F与I是同一主族的元素,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为__、__,BeF2分子的立体构型是___,H2O分子的立体构型是__。
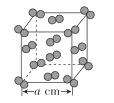
(5)I2晶体的晶胞结构如图所示,该晶胞中含有__个I2分子,设该晶胞的晶胞参数为acm,则I2的密度是__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol·L-1 H2SO4洗涤Fe粉,其目的是____,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入____(写化学式)。
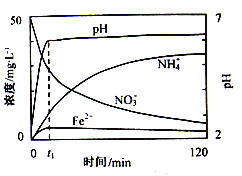
(2)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式____。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是____。
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:____;
假设三:____;
(4)请你设计实验验证上述假设一,补充实验步骤及结论:(已知:溶液中的NO3-浓度可用离子色谱仪测定)____、____。

查看答案和解析>>
科目:高中化学 来源: 题型:
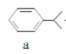
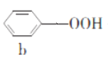
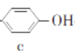
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下,下列有关说法正确的是
![]()
![]()
 +
+![]()
A.a、b、c均属于芳香烃B.a、d中所有碳原子均处于同一平面上
C.A有9种属于芳香族的同分异构体D.c、d均能发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com