
【题目】新技术的开发应用,不仅有利于改善环境质量,而且能充分开发“废物”的潜在价值。
回答下列问题:
(1)用烟道气与氢气来合成甲醇涉及到如下几个反应:
①CO(g)+2H2(g)=CH3OH(g) △H=-91kJ·mol-1
②2CO2(g)=2CO(g)+O2(g) △H=+566kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
④CO2(g)+3H2(g)=CH3OH(g)+H2O(g)H=__kJ·mol-1。
(2)在容积均为2L的两个恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),有关数据如下:
CO2(g)+H2(g),有关数据如下:

①800°C时该反应的平衡常数K=__。
②容器2中x=__,n=___。
③若800℃起始时,在2L恒容密闭容器中加入CO、H2O、CO2、H2各1mol,则此时v正__v逆(填“>”“<”或“=”)。
(3)反应(NH4)2CO3+H2O+CO2![]() 2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
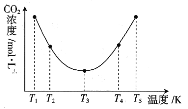
①H__0(填“>”“<”或“=”)。T1~T2区间,c(CO2)变化的原因是___。
②已知常温下NH3·H2O的电离常数K=1.8×10-5,碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,则恰好完全反应时所得的NH4HCO3溶液中c(H+)__c(OH-)(填“>”“<”或“=”)。
③在图中所示五种温度下,该反应的平衡常数最大的温度是__。
【答案】-49.8 1 ![]()
![]() 或66.7% = < T1~ T2区间,反应未平衡,温度上升反应速率加快,相同时间内捕捉的CO2越多,剩余的二氧化碳浓度就越小 < T1
或66.7% = < T1~ T2区间,反应未平衡,温度上升反应速率加快,相同时间内捕捉的CO2越多,剩余的二氧化碳浓度就越小 < T1
【解析】
(1))已知①CO(g)+2H2 (g)═CH3OH(g)△H=-91kJmol-1
②2CO2 (g)═2CO(g)+O2(g)△H=+566.0 kJmol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJmol-1 .
由盖斯定律可知,①+![]() (②+③)得CO2(g)+3H2(g)═CH3OH(g)+H2O(g),△H=-91kJmol-1 +
(②+③)得CO2(g)+3H2(g)═CH3OH(g)+H2O(g),△H=-91kJmol-1 +![]() ×(566.0 kJmol-1-483.6 kJmol-1 )=-49.8kJmol-1;
×(566.0 kJmol-1-483.6 kJmol-1 )=-49.8kJmol-1;
(2)①容器体积为2L,所以初始c(CO)=![]() ,c(H2)=
,c(H2)=![]() ;平衡时CO的转化率为
;平衡时CO的转化率为![]() ,即转化
,即转化![]() mol·L-1,列三段式:
mol·L-1,列三段式:
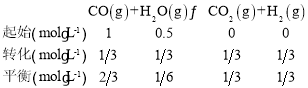
根据平衡常数的概念可知K=![]() =1;
=1;
②达到平衡时氢气的物质的量为nmol,则其浓度c(H2)=![]() ,列三段式有:
,列三段式有:
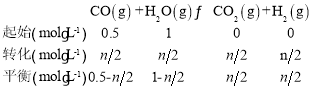
温度不变平衡常数不变,所以平衡常数K=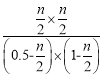 =1,解得n=
=1,解得n=![]() mol,CO的转化率为
mol,CO的转化率为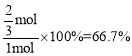 ;
;
③在2 L恒容密闭容器中加入CO、H2O、CO2、H2各1 mol,该反应前后气体系数之和相同,所以可用物质的量代替浓度计算,此时浓度商Q=![]() =K,所以平衡不发生移动,即v正=v逆;
=K,所以平衡不发生移动,即v正=v逆;
(3)①T3温度之前随温度上升,反应速率加快,所以相同时间内测得的CO2浓度下降,T3温度之后,在相同时间内反应已达到平衡,温度上升,平衡左移,CO2浓度上升,说明该反应的正反应为放热反应,即H<0;T1~ T2区间,反应未平衡,温度上升反应速率加快,相同时间内捕捉的CO2越多,剩余的二氧化碳浓度就越小;
②铵根的水解使溶液显酸性,碳酸氢根水解使溶液显碱性,铵根的水解平衡常数Kh=![]() ,碳酸氢根的水解平衡常数Kh=
,碳酸氢根的水解平衡常数Kh=![]() ,比较可知碳酸氢根的水解程度大于铵根的水解程度,所以溶液显碱性,即c(H+)<c(OH- );
,比较可知碳酸氢根的水解程度大于铵根的水解程度,所以溶液显碱性,即c(H+)<c(OH- );
③根据①可知该反应为放热反应,温度越高平衡常数越小,所以T1温度时平衡常数最大。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应mM(气) ![]() nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则( )
nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则( )
A.平衡逆向移动B.物质M的转化率增大C.n > mD.物质N的质量分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,则下列说法中正确的是
A.2克H2所含的原子数目为NA
B.2molO3和3molO2所含的氧原子数都是6NA
C.常温常压下,11.2L氧气含原子数为NA个
D.2.3g金属钠含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通过一段时间后,在阳极产生a mol气体,同时有WgNa2SO4·10H2O析出,若温度不变,此时剩余溶液中溶质的质量分数为( )
A.![]() ×100%B.
×100%B.![]() %C.
%C.![]() %D.
%D.![]() %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。
材料一 《唐本草》和《天工开物》等古籍都记载中国很早就能焙烧绿矾制备铁红(主要成分是Fe2O3)。铁红颜色鲜艳,稳定无毒,是中国传统红色颜料的重要着色剂。
材料二 公元8世纪,阿拉伯炼金家查比尔曾提出,把绿矾焙烧可以蒸馏出“矾精”,它具有比较大的溶解力。绿矾焙烧是一种生产硫酸的古老方法。
(1)某研究性学习小组用如图所示试验装置对绿矾的焙烧反应进行探究。
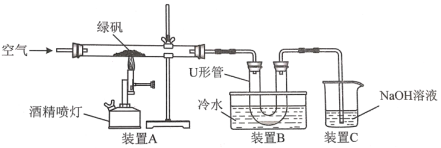
①实验过程中,装置A玻管中可观察到的实验现象是__。
②装置C的作用是__。
③该小组学生设计如下实验方案验证“矾精”是硫酸溶液:取U形管中的溶液少许于试管中,滴入__(填试剂名称),溶液呈红色,说明“矾精”中含有H+;检验“矾精”中含有SO42-的方法是__。
(2)某工厂计划用绿矾焙烧工艺生产高纯度铁红(Fe2O3)160kg,计算理论上所需绿矾的质量,写出计算过程。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示的装置对能量变化情况进行研究。当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升。不符合要求的X、Y可能是( )
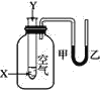
A.X是水,Y是浓硫酸
B.X是盐酸,Y是氢氧化钠溶液
C.X是硝酸铵固体,Y是水
D.X是铝粉,Y是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯盐可导致混凝土中的钢筋腐蚀。为防止混凝土中的钢筋腐蚀,可在混凝土表面敷置一定电解质溶液并将惰性金属导电网浸泡其中,惰性金属导电网与钢筋分别连接外部直流电源从而除去Cl-,装置如图,下列说法错误的是
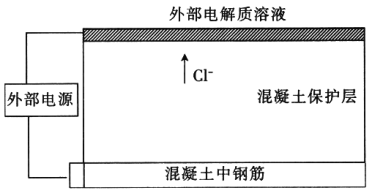
A. 钢筋接电源的正极
B. 金属导电网上发生的电极反应为2Cl—2e-=Cl2↑
C. 混凝土中的钙离子向钢筋方向移动
D. 电解一段时间后钢筋附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1000mol/L的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol/LNaOH溶液、0.1000mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示,下列说法不正确的是( )
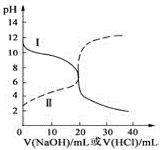
A.由滴定曲线,25℃时Ka(CH3COOH)=Kb(NH3·H2O)=10-5
B.当NaOH溶液和盐酸滴加到20.00mL时,曲线Ⅰ和Ⅱ刚好出现交点
C.曲线Ⅱ:滴加溶液到10.00mL时,溶液中c(CH3COO-)+c(OH-)>c(H+)
D.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中不正确的是( )
A.10℃时NaCl溶解度为35.7 g,则此时饱和NaCl溶液的质量分数小于35.7%
B.向Na2CO3溶液中加入少量NaHCO3固体,溶液pH减小
C.50 mL1.0 mol·L-1盐酸与60 mL 1.0 mol·L-1盐酸分别跟50 mL 1.1 mol·L-1的 NaOH溶液进行反应,中和热数值不相等
D.一定条件下,向水中加入少量Na2SO4,可使水的电离程度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com