
ЁОЬтФПЁПТЬЗЏ(FeSO4ЁЄ7H2O)ЪЧздШЛНчДцдкЕФвЛжжПѓЪЏЃЌДфТЬШчБІЪЏЃЌКмдчОЭв§Ц№ШЫУЧЕФжиЪгЁЃ
ВФСЯвЛ ЁЖЬЦБОВнЁЗКЭЁЖЬьЙЄПЊЮяЁЗЕШЙХМЎЖММЧдижаЙњКмдчОЭФмБКЩеТЬЗЏжЦБИЬњКь(жївЊГЩЗжЪЧFe2O3)ЁЃЬњКьбеЩЋЯЪбоЃЌЮШЖЈЮоЖОЃЌЪЧжаЙњДЋЭГКьЩЋбеСЯЕФживЊзХЩЋМСЁЃ
ВФСЯЖў ЙЋдЊ8ЪРМЭЃЌАЂРВЎСЖН№МвВщБШЖћдјЬсГіЃЌАбТЬЗЏБКЩеПЩвдеєСѓГіЁАЗЏОЋЁБЃЌЫќОпгаБШНЯДѓЕФШмНтСІЁЃТЬЗЏБКЩеЪЧвЛжжЩњВњСђЫсЕФЙХРЯЗНЗЈЁЃ
ЃЈ1ЃЉФГбаОПадбЇЯАаЁзщгУШчЭМЫљЪОЪдбщзАжУЖдТЬЗЏЕФБКЩеЗДгІНјааЬНОПЁЃ
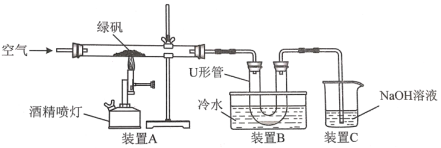
ЂйЪЕбщЙ§ГЬжаЃЌзАжУAВЃЙмжаПЩЙлВьЕНЕФЪЕбщЯжЯѓЪЧ__ЁЃ
ЂкзАжУCЕФзїгУЪЧ__ЁЃ
ЂлИУаЁзщбЇЩњЩшМЦШчЯТЪЕбщЗНАИбщжЄЁАЗЏОЋЁБЪЧСђЫсШмвКЃКШЁUаЮЙмжаЕФШмвКЩйаэгкЪдЙмжаЃЌЕЮШы__(ЬюЪдМСУћГЦ)ЃЌШмвКГЪКьЩЋЃЌЫЕУїЁАЗЏОЋЁБжаКЌгаHЃЋЃЛМьбщЁАЗЏОЋЁБжаКЌгаSO42-ЕФЗНЗЈЪЧ__ЁЃ
ЃЈ2ЃЉФГЙЄГЇМЦЛЎгУТЬЗЏБКЩеЙЄвеЩњВњИпДПЖШЬњКь(Fe2O3)160kgЃЌМЦЫуРэТлЩЯЫљашТЬЗЏЕФжЪСПЃЌаДГіМЦЫуЙ§ГЬЁЃ___ЁЃ
ЁОД№АИЁПТЬЩЋОЇЬхБфКьзиЩЋЗлФЉ ЮќЪеЮВЦјSO2ЃЌЗРжЙЮлШОЛЗОГ зЯЩЋЪЏШяЪдвК ШЁРфШДвКЩйаэгкЪдЙмжаЃЌЕЮМгЯЁбЮЫсЃЌУЛгаЯжЯѓЃЌдйМгШыТШЛЏБЕШмвКЃЌШчЙћгаАзЩЋГСЕэЩњГЩЃЌЫЕУїКЌгаSO42- 278kg
ЁОНтЮіЁП
ЃЈ1ЃЉЂйвРОнЗДгІЮяКЭЩњГЩЮяХаЖЯЯжЯѓЃЛ
ЂкЖўбѕЛЏСђЮлШОПеЦјЃЌВЛФмШЮвтХХЗХЃЌЗжЮіЧтбѕЛЏФЦШмвКЕФзїгУЃЛ
ЂлвРОнГЃМћбєРызгКЭвѕРызгМьбщЗНЗЈЗжЮіЃЛ
ЃЈ2ЃЉвРОндзгЪиКуНјааМЦЫуЁЃ
ЃЈ1ЃЉЂйБКЩеТЬЗЏжЦБИЬњКь(жївЊГЩЗжЪЧFe2O3)ЃЌЪЕбщЙ§ГЬжаЃЌзАжУAВЃЙмжаПЩЙлВьЕНЕФЪЕбщЯжЯѓЪЧТЬЩЋОЇЬхБфКьзиЩЋЗлФЉЃЌ
ЙЪД№АИЮЊЃКТЬЩЋОЇЬхБфКьзиЩЋЗлФЉЃЛ
ЂкдкПеЦјжаМгШШТЬЗЏЃЌЛсЩњГЩЖўбѕЛЏСђЃЌЖўбѕЛЏСђЛсЮлШОПеЦјЃЌВЛФмШЮвтХХЗХЃЌЫљвдзїгУЪЧЮќЪеЖўбѕЛЏСђЃЌЗРжЙЮлШОПеЦјЃЌ
ЙЪД№АИЮЊЃКЮќЪеЮВЦјSO2ЃЌЗРжЙЮлШОЛЗОГЃЛ
ЂлМьбщЧтРызггУзЯЩЋЪЏШяЪдвКЃЌШмвКБфКьЩЋЃЌМьбщЁАЗЏОЋЁБжаКЌгаSO42-ЕФЗНЗЈЪЧШЁРфШДвКЩйаэгкЪдЙмжаЃЌЕЮМгЯЁбЮЫсЃЌУЛгаЯжЯѓЃЌдйМгШыТШЛЏБЕШмвКЃЌШчЙћгаАзЩЋГСЕэЩњГЩЃЌЫЕУїКЌгаSO42-ЃЌ
ЙЪД№АИЮЊЃКзЯЩЋЪЏШяЪдвКЃЛШЁРфШДвКЩйаэгкЪдЙмжаЃЌЕЮМгЯЁбЮЫсЃЌУЛгаЯжЯѓЃЌдйМгШыТШЛЏБЕШмвКЃЌШчЙћгаАзЩЋГСЕэЩњГЩЃЌЫЕУїКЌгаSO42-ЃЛ
ЃЈ2ЃЉРћгУЬњдзгЪиКуЕУЃКmЃЈТЬЗЏЃЉ=![]() ЁС2ЁСM(ТЬЗЏ)=
ЁС2ЁСM(ТЬЗЏ)=![]() ЁС2ЁС278g/mol=278kgЃЌЙЪД№АИЮЊЃК278kgЁЃ
ЁС2ЁС278g/mol=278kgЃЌЙЪД№АИЮЊЃК278kgЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМИжжЖЬжмЦкдЊЫиЕФдзгАыОЖМАжївЊЛЏКЯМлШчЯТБэЃКвбжЊXЪЧЖЬжмЦкжазюЛюЦУЕФН№ЪєЃЌЧвгыRЭЌжмЦкЁЃ(ЧыгУЛЏбЇгУгяД№Ьт)
дЊЫиДњКХ | X | Y | Z | M | R |
дзгАыОЖ/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
жївЊЛЏКЯМл | ЃЋ1 | ЃЋ6 Ѓ2 | ЃЋ5 Ѓ3 | Ѓ2 | ЃЋ3 |
ЃЈ1ЃЉRЕФдЊЫиЗћКХЮЊ___ЃЌMдкдЊЫижмЦкБэжаЕФЮЛжУЮЊ___ЁЃ
ЃЈ2ЃЉXгыYАДдзгИіЪ§БШ1ЁУ1ЙЙГЩЕФЮяжЪЕФЕчзгЪНЮЊ___ЃЌЫљКЌЛЏбЇМќРраЭ___ЁЃ
ЃЈ3ЃЉXЃЋЁЂY2-ЁЂM2-РызгАыОЖДѓаЁЫГађЮЊ___ЁЃ
ЃЈ4ЃЉНЋYM2ЭЈШыFeCl3ШмвКжаЕФРызгЗНГЬЪНЃК___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
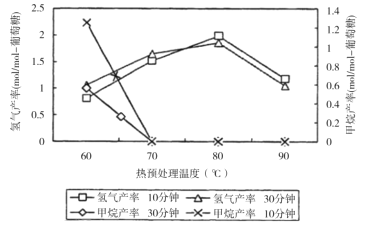
ЁОЬтФПЁПМзЭщЫЎеєЦјЕФжиећЗДгІЪЧЙЄвЕжЦБИЧтЦјЕФживЊЗНЪНЃЌЦфЛЏбЇЗДгІЗНГЬЪНЮЊCH4(g)+H2O(g)![]() CO(g)+3H2(g)ЁЃЛиД№ЯТСаЮЪЬтЃК
CO(g)+3H2(g)ЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉвбжЊЃКCH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJЁЄmol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJЁЄmol-1
O2(g)=CO(g) H2=-283.0kJЁЄmol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
дђМзЭщЫЎеєЦјжиећЗДгІЕФЁїH=__kJЁЄmol-1ЁЃ
ЃЈ2ЃЉЭЈЙ§МЦЫуЛњФЃФтЪЕбщЃЌЖд400~1200ЁцЁЂВйзїбЙЧПЮЊ0.1MPaЬѕМўЯТЃЌВЛЭЌЫЎЬМБШ(1~10)НјааСЫШШСІбЇМЦЫуЃЌЗДгІЦНКтЬхЯЕжаH2ЕФЮяжЪЕФСПЗжЪ§гыЫЎЬМБШЁЂЦНКтЮТЖШЕФЙиЯЕШчЭМЫљЪОЁЃ
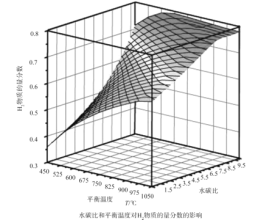
ЂйH2ЕФЮяжЪЕФСПЗжЪ§гыЫЎЬМБШ(1~10)ЕФЙиЯЕЪЧЦНКтЮТЖШвЛЖЈЪБЃЌ__ЃЛЦфдвђЪЧ__ЁЃ
ЂкОнФЃФтЪЕбщПЩжЊЃЌЦНКтЮТЖШЮЊ900ЁцЃЌЫЎЬМБШЮЊ1.0ЪБЃЌH2ЕФЮяжЪЕФСПЗжЪ§ЮЊ0.6ЃЌCH4ЕФзЊЛЏТЪЮЊ__ЃЌЦфбЙЧПЦНКтГЃЪ§ЮЊ__ЃЛЗДгІЫйТЪЗНГЬЮЊv=kp(CH4)p-1(H2)ЃЌДЫЪБЗДгІЫйТЪ=__(вбжЊЃКЦјЬхЗжбЙ=ЦјЬхЕФЮяжЪЕФСПЗжЪ§ЁСзмбЙЃЌЫйТЪЗНГЬжаkЮЊЫйТЪГЃЪ§)ЁЃ
ЃЈ3ЃЉбсбѕЯИОњПЩНЋЦЯЬбЬЧзЊЛЏЮЊCH4КЭH2ЃЌpHЮЊ5.5ЪБВЛЭЌШШдЄДІРэЮТЖШКЭЪБМфЯТЕФМзЭщКЭЧтЦјЕФВњТЪШчЭМЫљЪОЃЌШєвЊЬсИпH2ЕФВњТЪЃЌзюМбЮТЖШЮЊ__ЃЛгыМзЭщЫЎеєЦјжиећжЦЧтЯрБШЦфгХЕуга__(жСЩйаДСНЕу)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЛњЛЏбЇЗДгІЗНГЬЪНМАЗДгІРраЭОље§ШЗЕФЪЧ
бЁЯю | ЛЏбЇЗДгІЗНГЬЪН | ЗДгІРраЭ |
A | CH3COOHЃЋCH3CH2OH | ѕЅЛЏЗДгІ |
B | CH4ЃЋCl2 | жУЛЛЗДгІ |
C | CH2=CH2ЃЋBr2 CH3CHBr2 | МгГЩЗДгІ |
D |
| ШЁДњЗДгІ |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
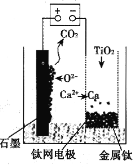
ЁОЬтФПЁПЙЄвЕЁЂЩЯГЃгУюбЬњПѓ[жївЊГЩЗжЮЊFeTiO3(юбЫсбЧЬњЃЌВЛШмгкЫЎ)ЁЂFe2O3МАЩйСПSiO2дгжЪ]зїдСЯЃЌжЦШЁЖўбѕЛЏюбМАЬњКьЃЌЦфЩњВњСїГЬШчЭМЃК
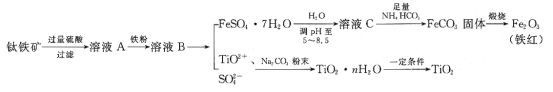
вбжЊЃКTiO2+взЫЎНтЃЌжЛФмДцдкгкЧПЫсадШмвКжаЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉюбЬњПѓгУСђЫсШмНтЪБЃЌЙ§ТЫЫљЕУТЫдќЕФГЩЗжЪЧ__(ЬюЛЏбЇЪН)ЁЃ
ЃЈ2ЃЉДгШмвКBжаЕУЕНFeSO4ЁЄ7H2OОЇЬхЕФВйзїЪЧ__ЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЁЃ
ЃЈ3ЃЉШмвКCжаМгШыNH4HCO3ЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧ__ЁЃ
ЃЈ4ЃЉьбЩеFeCO3ЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__ЁЃ
ЃЈ5ЃЉСїГЬжаМгШыNa2CO3ЗлФЉЕУЕНЙЬЬхTiO2ЁЄnH2OЁЃЧыНсКЯTiO2+ЕФЫЎНтЦНКтдРэНтЪЭЦфдвђЃК__ЁЃ
ЃЈ6ЃЉгУШчЭМЫљЪОзАжУ(ШлШкCaF2-CaOзїЕчНтжЪ)ЛёЕУН№ЪєИЦЃЌВЂгУИЦЛЙдTiO2жЦШЁН№ЪєюбЁЃбєМЋЗДгІЪНЪЧ__ЃЌЗДгІЙ§ГЬжаCaOЕФЮяжЪЕФСП__(ЬюЁАМѕаЁЁБЁАВЛБфЁБЛђЁАдіДѓЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаТММЪѕЕФПЊЗЂгІгУЃЌВЛНігаРћгкИФЩЦЛЗОГжЪСПЃЌЖјЧвФмГфЗжПЊЗЂЁАЗЯЮяЁБЕФЧБдкМлжЕЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉгУбЬЕРЦјгыЧтЦјРДКЯГЩМзДМЩцМАЕНШчЯТМИИіЗДгІЃК
ЂйCO(g)+2H2(g)=CH3OH(g) ЁїH=-91kJЁЄmol-1
Ђк2CO2(g)=2CO(g)+O2(g) ЁїH=+566kJЁЄmol-1
Ђл2H2(g)+O2(g)=2H2O(g) ЁїH=-483.6kJЁЄmol-1
ЂмCO2(g)+3H2(g)=CH3OH(g)+H2O(g)H=__kJЁЄmol-1ЁЃ
ЃЈ2ЃЉдкШнЛ§ОљЮЊ2LЕФСНИіКуШнУмБеШнЦїжаЗЂЩњЗДгІCO(g)+H2O(g)![]() CO2(g)+H2(g)ЃЌгаЙиЪ§ОнШчЯТЃК
CO2(g)+H2(g)ЃЌгаЙиЪ§ОнШчЯТЃК

Ђй800ЁуCЪБИУЗДгІЕФЦНКтГЃЪ§K=__ЁЃ
ЂкШнЦї2жаx=__ЃЌn=___ЁЃ
ЂлШє800ЁцЦ№ЪМЪБЃЌдк2LКуШнУмБеШнЦїжаМгШыCOЁЂH2OЁЂCO2ЁЂH2Иї1molЃЌдђДЫЪБvе§__vФц(ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)ЁЃ
ЃЈ3ЃЉЗДгІ(NH4)2CO3+H2O+CO2![]() 2NH4HCO3OHПЩгУгкВЖзНПеЦјжаЕФCO2ЃЌЮЊбаОПЮТЖШЖд(NH4)2CO3ВЖЛёCO2аЇТЪЕФгАЯьЃЌдкФГЮТЖШT1ЯТЃЌНЋвЛЖЈСПЕФ(NH4)2CO3ШмвКжУгкУмБеШнЦїжаЃЌВЂГфШывЛЖЈСПЕФCO2ЦјЬхЃЌдкtЪБПЬЃЌВтЕУШнЦїжаCO2ЦјЬхЕФХЈЖШЁЃШЛКѓЗжБ№дкЮТЖШЮЊT2ЁЂT3ЁЂT4ЁЂT5ЯТЃЌБЃГжЦфЫћГѕЪМЪЕбщЬѕМўВЛБфЃЌжиИДЩЯЪіЪЕбщЃЌОЙ§ЯрЭЌЪБМфВтЖЈCO2ЦјЬхЕФХЈЖШЃЌЕУЕНЕФЧњЯпЭМШчЭМЃК
2NH4HCO3OHПЩгУгкВЖзНПеЦјжаЕФCO2ЃЌЮЊбаОПЮТЖШЖд(NH4)2CO3ВЖЛёCO2аЇТЪЕФгАЯьЃЌдкФГЮТЖШT1ЯТЃЌНЋвЛЖЈСПЕФ(NH4)2CO3ШмвКжУгкУмБеШнЦїжаЃЌВЂГфШывЛЖЈСПЕФCO2ЦјЬхЃЌдкtЪБПЬЃЌВтЕУШнЦїжаCO2ЦјЬхЕФХЈЖШЁЃШЛКѓЗжБ№дкЮТЖШЮЊT2ЁЂT3ЁЂT4ЁЂT5ЯТЃЌБЃГжЦфЫћГѕЪМЪЕбщЬѕМўВЛБфЃЌжиИДЩЯЪіЪЕбщЃЌОЙ§ЯрЭЌЪБМфВтЖЈCO2ЦјЬхЕФХЈЖШЃЌЕУЕНЕФЧњЯпЭМШчЭМЃК
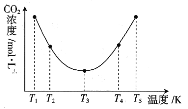
ЂйH__0(ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)ЁЃT1~T2ЧјМфЃЌc(CO2)БфЛЏЕФдвђЪЧ___ЁЃ
ЂквбжЊГЃЮТЯТNH3ЁЄH2OЕФЕчРыГЃЪ§K=1.8ЁС10-5ЃЌЬМЫсЕФЕчРыГЃЪ§K1=4.4ЁС10-7ЁЂK2=4.7ЁС10-11ЃЌдђЧЁКУЭъШЋЗДгІЪБЫљЕУЕФNH4HCO3ШмвКжаc(H+)__c(OH-)(ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)ЁЃ
ЂлдкЭМжаЫљЪОЮхжжЮТЖШЯТЃЌИУЗДгІЕФЦНКтГЃЪ§зюДѓЕФЮТЖШЪЧ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаШШЛЏбЇЗНГЬЪНБэДяе§ШЗЕФЪЧЃЈІЄHЕФОјЖджЕОље§ШЗЃЉЃЈЁЁЁЁЃЉ
A.C2H5OHЃЈ1ЃЉ+3O2ЃЈgЃЉ=2CO2ЃЈgЃЉ+3H2OЃЈgЃЉІЄH=Љ1367.0 kJЁЄ![]() ЃЈШМЩеШШЃЉ
ЃЈШМЩеШШЃЉ
B.NaOHЃЈaqЃЉ+HClЃЈaqЃЉ=NaClЃЈaqЃЉ+H2OЃЈ1ЃЉ ІЄH=+57.3 kJЁЄ![]() ЃЈжаКЭШШЃЉ
ЃЈжаКЭШШЃЉ
C.SЃЈsЃЉ+O2ЃЈgЃЉ=SO2ЃЈgЃЉ ІЄH=Љ269.8 kJЁЄ![]() ЃЈЗДгІШШЃЉ
ЃЈЗДгІШШЃЉ
D.2NO2=O2+2NO ІЄH=+116.2 kJЁЄ![]() ЃЈЗДгІШШЃЉ
ЃЈЗДгІШШЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГNiOЕФЗЯСЯжагаFeOЁЂCuOЁЂAl2O3ЁЂMgOЁЂSiO2ЕШдгжЪЃЌгУДЫЗЯСЯЬсШЁNiSO4КЭNiЕФСїГЬШчЯТЃК
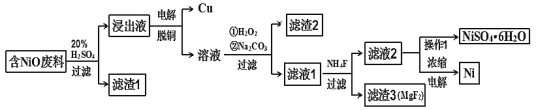
вбжЊЃКгаЙиН№ЪєРызгЩњГЩЧтбѕЛЏЮяГСЕэЫљашЕФpHШчЭМЃК

ЃЈ1ЃЉТЫдќ1ЕФжївЊГЩЗжЮЊ____ЁЃ
ЃЈ2ЃЉЂйгУРызгЗНГЬЪННтЪЭМгШыH2O2ЕФзїгУ____ЁЃ
ЂкМгNa2CO3ЕїНкШмвКЕФpHжС5ЃЌдђТЫдќ2ЕФжївЊГЩЗжЮЊ____ЁЃ
ЃЈ3ЃЉДгТЫвК2жаЛёЕУNiSO4ЁЄ6H2OЕФЪЕбщВйзїЪЧ____ЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЁЃ
ЃЈ4ЃЉЕчНтХЈЫѕКѓЕФТЫвК2ПЩЛёЕУН№ЪєФјЃЌЦфЛљБОЗДгІдРэЪОвтЭМШчЭМЃК
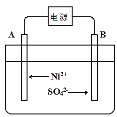
ЂйBМЋИННќpHЛс____ЃЈЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЃЛгУЦНКтвЦЖЏдРэНтЪЭBМЋИННќpHБфЛЏЕФдвђЃК____ЁЃ
ЂквЛЖЮЪБМфКѓЃЌдкAЁЂBСНМЋОљЪеМЏЕН11.2LЦјЬх(БъзМзДПіЯТ)ЃЌРэТлЩЯФмЕУЕНNi____gЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЪЧФГЮоЛњЛЏКЯЮяЕФЖўОлЗжзгЃЌИУЗжзгжаAЁЂBСНжждЊЫиЖМжЛга3ИіФмВуЃЌЗжзгжаЫљгадзгЕФзюЭтВуЖМДяЕН8ИіЕчзгЕФЮШЖЈНсЙЙЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
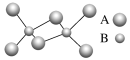
A.дЊЫиAЮЛгкдЊЫижмЦкБэЕкШ§жмЦкЕкЂѓAзх
B.ИУЛЏКЯЮяЪЧЙВМлЛЏКЯЮяЃЌдкШлШкзДЬЌЯТФмЕМЕч
C.ИУЛЏКЯЮядкЙЬЬЌЪБЫљаЮГЩЕФОЇЬхЪЧЗжзгОЇЬх
D.ИУЛЏКЯЮяжаДцдкМЋадЙВМлМќЃЌЮоЗЧМЋадЙВМлМќ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com