
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
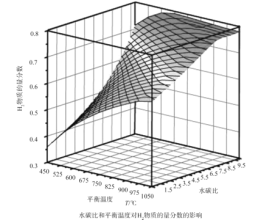
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
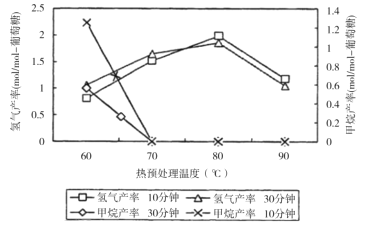
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
【答案】+206.3 水碳比越大,H2的物质的量分数越大 水碳比较大时,CO会与H2O进一步反应生成H2,使H2的物质的量分数增大 66.67% 4.32×102(MPa)2 ![]() 80℃ 原料来源广、制取H2温度低、不会产生CO等有害气体等
80℃ 原料来源广、制取H2温度低、不会产生CO等有害气体等
【解析】
(1)用盖斯定律求甲烷水蒸气重整反应的△H;
(2)①H2的物质的量分数与水碳比(1~10)的关系由图知;原因从生成氢气的反应角度来回答;
②平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率、其压强平衡常数;以及此时反应速率通过三段式计算;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,提高H2的产率的最佳温度,由图知;与甲烷水蒸气重整制氢相比的优点从反应的难易程度及环保、经济等角度来考察。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1②CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1③H2(g)+
O2(g)=CO(g) H2=-283.0kJ·mol-1③H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1④CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1,根据盖斯定律,①+④2×②2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)
O2(g)=H2O(l) H3=-285.8kJmol-1④CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1,根据盖斯定律,①+④2×②2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g),则甲烷水蒸气重整反应ΔH=ΔH1+ΔH42ΔH22ΔH3=(890.341+2×283.0+2×285.8) kJmol1=+206.3 kJmol1;
CO(g)+3H2(g),则甲烷水蒸气重整反应ΔH=ΔH1+ΔH42ΔH22ΔH3=(890.341+2×283.0+2×285.8) kJmol1=+206.3 kJmol1;
答案为:+206.3;
(2)①平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系,由图中曲线走势可知;
答案为:水碳比越大,H2的物质的量分数越大;
水碳比越大,H2的物质的量分数越大的原因,从生成氢气的反应可知,除了甲烷水蒸气的重整反应生成氢气外,一氧化碳和水也会反应产生氢气;
答案为:当水碳比较大时,CO会与H2O反应生成H2,使H2的物质的量分数增大;
②操作压强为0.1MPa、平衡温度为900℃条件下,水碳比为1.0时,H2的物质的量分数为0.6,设甲烷和H2O的物质的量均为amol,达化学平衡时,甲烷消耗x,
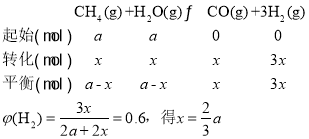 ,则CH4的转化率
,则CH4的转化率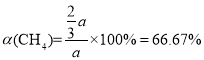
答案为:66.67%;
已知:气体分压=气体的物质的量分数×总压,
![]() ,
,![]() ,压强平衡常数为
,压强平衡常数为![]() ;
;
答案为:4.32×102(MPa)2;
反应速率方程为v=kp(CH4)p-1(H2),此时反应速率![]() ;
;
答案为:![]() ;
;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时,若要提高H2的产率,降低甲烷产率,最佳温度为80℃;与甲烷水蒸气重整制氢相比其优点有原料来源广、制取H2温度低、不会产生CO等有害气体等;
答案为:80℃;原料来源广、制取H2温度低、不会产生CO等有害气体等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个体积均为0.5L的密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:

下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.1mol·L-1·min-1
B.x=1
C.由图可知:T1<T2,且该反应为吸热反应
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.热化学方程式C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,可知乙炔的燃烧热为1256kJ·mol-1
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,可知乙炔的燃烧热为1256kJ·mol-1
C.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
D.稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(III)和V(IV)形式存在,由含矾石煤提钒的一种工艺流程如图所示:
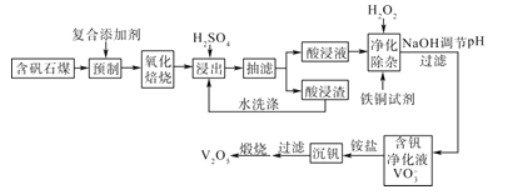
已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
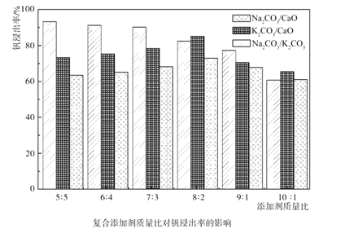
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__,最佳添加比例为__。
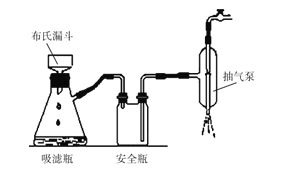
(2)如图为“抽滤”实验原理装置图,"抽滤”时抽气泵的作用是__;“酸浸渣”经“水洗涤”返回“浸出”的目的是__。
(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为__。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__。
(4)“沉钒”的离子反应方程式为___。
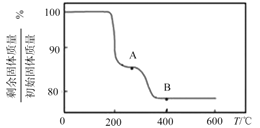
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%)。则A点对应物质的化学式为__,B点对应的物质为V2O5,则B点坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
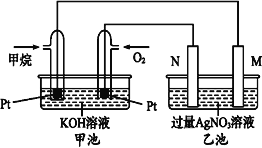
(1)M电极的材料是_____, 其电极反应式为:_______。N的电极名称是_____,其电极反应式为:_____。
(2)通入O2的铂电极的电极反应式为:________。
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为_____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,则下列说法中正确的是
A.2克H2所含的原子数目为NA
B.2molO3和3molO2所含的氧原子数都是6NA
C.常温常压下,11.2L氧气含原子数为NA个
D.2.3g金属钠含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,生成H2的体积为112mL
C.常温常压下,3.2 g O2所含的原子数为0.2NA
D.标准状况下,2.24 LH2O含有的H2O分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。
材料一 《唐本草》和《天工开物》等古籍都记载中国很早就能焙烧绿矾制备铁红(主要成分是Fe2O3)。铁红颜色鲜艳,稳定无毒,是中国传统红色颜料的重要着色剂。
材料二 公元8世纪,阿拉伯炼金家查比尔曾提出,把绿矾焙烧可以蒸馏出“矾精”,它具有比较大的溶解力。绿矾焙烧是一种生产硫酸的古老方法。
(1)某研究性学习小组用如图所示试验装置对绿矾的焙烧反应进行探究。
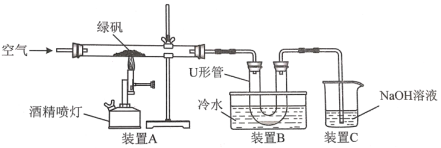
①实验过程中,装置A玻管中可观察到的实验现象是__。
②装置C的作用是__。
③该小组学生设计如下实验方案验证“矾精”是硫酸溶液:取U形管中的溶液少许于试管中,滴入__(填试剂名称),溶液呈红色,说明“矾精”中含有H+;检验“矾精”中含有SO42-的方法是__。
(2)某工厂计划用绿矾焙烧工艺生产高纯度铁红(Fe2O3)160kg,计算理论上所需绿矾的质量,写出计算过程。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年奥运会即将在北京举行,下列有关说法不正确的是 ( )
A.祥云火炬的燃料是丙烷,其分子式为![]()
B.奥运会将严查运动员服用兴奋剂,有—种兴奋剂的结构简式为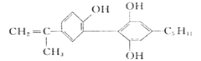 ,其分子式为C20H24O3
,其分子式为C20H24O3
C.奥运会所使用的锂电池为高能电池,其显著特点是提供相同电量时所需的金属正极质量最小
D.“金镶玉”奖牌中玉的化学成分主要是含水钙镁硅酸盐,如![]() ,可表示为
,可表示为![]() ·
·![]() ·
·![]() ·
·![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com