
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(III)和V(IV)形式存在,由含矾石煤提钒的一种工艺流程如图所示:
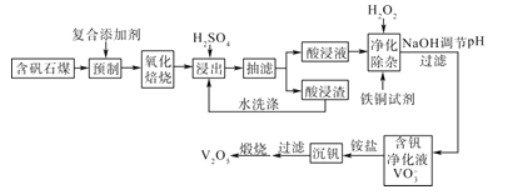
已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
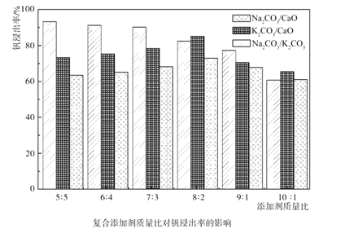
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__,最佳添加比例为__。
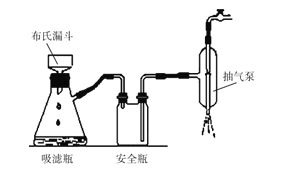
(2)如图为“抽滤”实验原理装置图,"抽滤”时抽气泵的作用是__;“酸浸渣”经“水洗涤”返回“浸出”的目的是__。
(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为__。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__。
(4)“沉钒”的离子反应方程式为___。
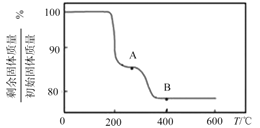
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%)。则A点对应物质的化学式为__,B点对应的物质为V2O5,则B点坐标为___。
【答案】Na2CO3/K2CO3 1:1 抽走装置中的空气,形成负压,加快过滤速率 提高钒浸出率 ![]() 若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失
若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失 ![]() HVO3 (400℃,77.78%)
HVO3 (400℃,77.78%)
【解析】
(1)读图找出最佳复合添加剂及最佳添加比例;
(2)从从抽滤的原理来回答作用;“酸浸渣”经“水洗涤”返回“浸出”的目的从提高原料利用率的角度回答;
(3)结合氧化还原反应的规律写离子方程式,“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因,从二种方法的优劣比较来回答;
(4)读图找到产生沉淀的反应物,据此写“沉钒”的离子反应方程式;
(5)读图,结合质量守恒定律中元素质量守恒计算和化学反应规律回答。
(1)据图可知,Na2CO3/K2CO3作复合添加剂时,钒浸出率最高,添加比例为1:1;
故答案为:Na2CO3/K2CO3;1:1;
(2)"抽滤"比过滤效果好速度快的原因是装置内外压强差大,是利用抽气泵使吸滤瓶中的压强降低,使过滤速度加快;
答案为:抽走装置中的空气,形成负压,加快过滤速率;
“酸浸渣”经“水洗涤”返回“浸出"可提高钒元素的浸出率;
答案为:提高钒浸出率;
(3) V2O24+被H2O2氧化成VO2+,H2O2作氧化剂,其还原产物为水,则离子方程式为:![]() ;
;
答案为:![]() ;
;
按信息,铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物而除去,若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失;
答案为:若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失;
(4)据流程图知,“含钒净化液”中的![]() 与铵盐中
与铵盐中![]() 结合生成
结合生成![]() 沉淀;
沉淀;
答案为:![]() ;
;
(5) 260℃时若分解生成HVO3和NH3,则剩余固体质量与初始固体质量的百分比为![]() ×100%≈85.47%,所以A点(260℃ )对应物质的化学式为HVO3;
×100%≈85.47%,所以A点(260℃ )对应物质的化学式为HVO3;
答案为:HVO3;
B点对应的物质为V2O5 ,根据质量变化特点,可以得出剩余固体质量与初始固体质量的百分比为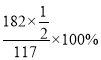 ≈77.78%,则B点坐标为(400℃,77.78%);
≈77.78%,则B点坐标为(400℃,77.78%);
答案为:(400℃,77.78%)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)氢氧化铁受热分解化学方程式:___。
(2)Al(OH)3与NaOH溶液反应的离子方程式:___。
(3)铁溶于盐酸的离子方程式:___。
(4)Na2O2与CO2反应的化学方程式:___。
(5)乙烯的结构式:___。
(6)乙烯的电子式:___。
(7)Na2O2的电子式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为___,M在元素周期表中的位置为___。
(2)X与Y按原子个数比1∶1构成的物质的电子式为___,所含化学键类型___。
(3)X+、Y2-、M2-离子半径大小顺序为___。
(4)将YM2通入FeCl3溶液中的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2![]() H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是

A.a极的电势低于b极
B.Y膜为选择性阴离子交换膜
C.每转移0.4 mol e-,就有0.1 mol H2O2生成
D.b极的电极反应为O2 + 2e- + H2O = HO2- + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
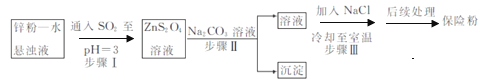
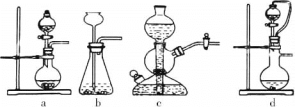
①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
①C(s)+CO2(g)2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_______。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2 molCuO,发生反应②,5 min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0~5 min内,用CO2表示的反应速率v(CO2)=____。
②CO的平衡转化率α=_______。
(3)向5L密闭容器中加入1molC和1molCO2,发生反应①,CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示:
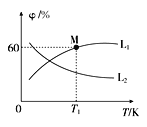
①能表示CO2的平衡体积分数与温度关系的曲线为____(填“L1”或“L2”),理由为_______。
②温度为T1时,该反应的平衡常数K=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
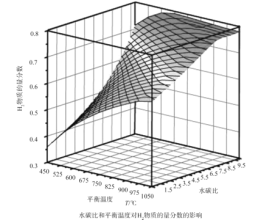
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
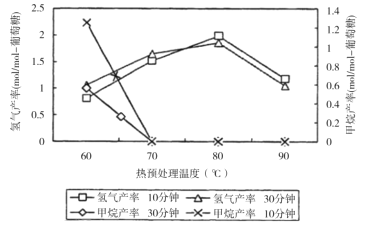
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式及反应类型均正确的是
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 酯化反应 |
B | CH4+Cl2 | 置换反应 |
C | CH2=CH2+Br2 CH3CHBr2 | 加成反应 |
D |
| 取代反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
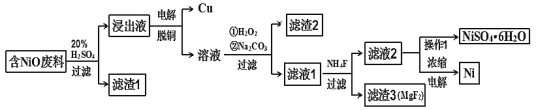
已知:有关金属离子生成氢氧化物沉淀所需的pH如图:

(1)滤渣1的主要成分为____。
(2)①用离子方程式解释加入H2O2的作用____。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为____。
(3)从滤液2中获得NiSO4·6H2O的实验操作是____、过滤、洗涤、干燥。
(4)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如图:
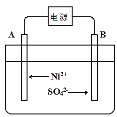
①B极附近pH会____(填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因:____。
②一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com