
【题目】几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为___,M在元素周期表中的位置为___。
(2)X与Y按原子个数比1∶1构成的物质的电子式为___,所含化学键类型___。
(3)X+、Y2-、M2-离子半径大小顺序为___。
(4)将YM2通入FeCl3溶液中的离子方程式:___。
【答案】Al 第二周期ⅥA族 ![]() 离子键、共价键(或非极性共价键) S2->O2->Na+ SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
离子键、共价键(或非极性共价键) S2->O2->Na+ SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
【解析】
根据Y的化合价,推出Y为S,M的化合价为-2价,位于VIA族,即M为O,根据Z的化合价,推出Z为VA族,对比X和Y的原子半径大小,推出Z为N,根据R的化合价以及原子半径,推出R为Al,X为Na,据此分析;
主族元素中最高价等于最外层电子数等于族序数,即X位于IA族,Y和M位于VIA族,Z位于VA族,R为IIIA组,同主族从上到下,原子半径依次增大,同周期从左向右原子半径依次减小,推出五种元素分别为Na、S、N、O、Al,
(1)根据上述分析R为Al;M为O元素,位于第二周期VIA族;
答案为Al;第二周期VIA族;
(2)Na和S按原子个数比为1:1构成的物质是Na2S2,其电子式类似Na2O2的电子式,即Na2S2的电子式为![]() ;含有化学键为离子键和非极性共价键;
;含有化学键为离子键和非极性共价键;
答案为![]() ;离子键和(非极性)共价键;
;离子键和(非极性)共价键;
(3)三种离子分别是Na+、S2-、O2-,其离子半径大小顺序是r(S2-)>r(O2-)>r(Na+);
答案为:S2->O2->Na+;
(4)SO2通入FeCl3溶液中,SO2具有还原性,能被Fe3+氧化成SO42-,Fe3+被还原成Fe2+,离子方程式为SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;
答案为SO2+2Fe3++2H2O=2Fe2++SO42-+4H+。


科目:高中化学 来源: 题型:
【题目】有机物的分子式为C6H12N4,分子中每个N原子分别与三个C原子键合,而每个C原子分别与两个N原子键合。分子中没有C=C双键和C-C单键。试写出该有机物的结构简式___;该分子中有___个六元环;每个六元环占有___个氮原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个体积均为0.5L的密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:

下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.1mol·L-1·min-1
B.x=1
C.由图可知:T1<T2,且该反应为吸热反应
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国的铀工业自20世纪50年代兴起,现已形成完整的和具有相当规模的科研和工业生产体系。铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4〔UO2(CO3)3〕等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。
①基态氟原子的价电子排布图为_____________;
②金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______;
③UF4用Mg或Ca还原时,其氧化产物是MgF2或CaF2,已知MgF2的熔点高于CaF2,其原因是_________________。
(2)已知:(NH4)4〔UO2(CO3)3〕![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①(NH4)4〔UO2(CO3)3〕存在的微粒间作用力是_________;
a. 离子键 b. 共价键 c. 配位键 d. 金属键
②NH4+的空间构型为______,与NH4+等电子体的分子或离子有_____(写一种);
③CO32-中碳原子杂化轨道类型为_________;
(3)UO2的晶胞结构如图所示:

①晶胞中U原子位于面心和顶点,氧原子填充在U原子堆积形成的空隙中,在该空隙中氧原子堆积形成的立体的空间构型为___________(填“立方体”、“四面体”、“八面体”);
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为__________g·cm-3。(列出含a算式即可。用NA表示阿伏加德罗常数的值。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧耗O2的量不变的是
A.甲烷、甲醇、甲醛;B.乙炔、苯、1,3-丁二烯
C.丙烯、2-丁烯、环已烷D.乙醇、乙烯、丙烯酸(CH2=CH-COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应mM(气) ![]() nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则( )
nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则( )
A.平衡逆向移动B.物质M的转化率增大C.n > mD.物质N的质量分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.热化学方程式C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,可知乙炔的燃烧热为1256kJ·mol-1
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,可知乙炔的燃烧热为1256kJ·mol-1
C.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
D.稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(III)和V(IV)形式存在,由含矾石煤提钒的一种工艺流程如图所示:
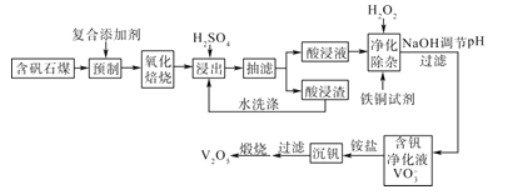
已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
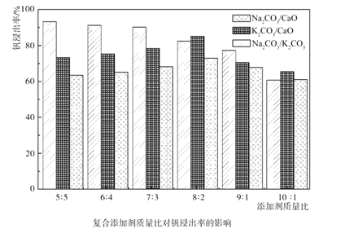
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__,最佳添加比例为__。
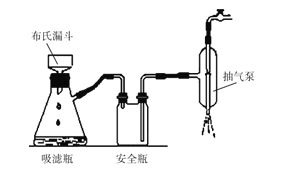
(2)如图为“抽滤”实验原理装置图,"抽滤”时抽气泵的作用是__;“酸浸渣”经“水洗涤”返回“浸出”的目的是__。
(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为__。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__。
(4)“沉钒”的离子反应方程式为___。
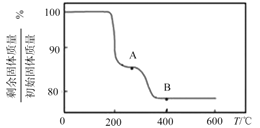
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%)。则A点对应物质的化学式为__,B点对应的物质为V2O5,则B点坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。
材料一 《唐本草》和《天工开物》等古籍都记载中国很早就能焙烧绿矾制备铁红(主要成分是Fe2O3)。铁红颜色鲜艳,稳定无毒,是中国传统红色颜料的重要着色剂。
材料二 公元8世纪,阿拉伯炼金家查比尔曾提出,把绿矾焙烧可以蒸馏出“矾精”,它具有比较大的溶解力。绿矾焙烧是一种生产硫酸的古老方法。
(1)某研究性学习小组用如图所示试验装置对绿矾的焙烧反应进行探究。
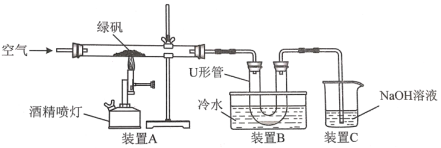
①实验过程中,装置A玻管中可观察到的实验现象是__。
②装置C的作用是__。
③该小组学生设计如下实验方案验证“矾精”是硫酸溶液:取U形管中的溶液少许于试管中,滴入__(填试剂名称),溶液呈红色,说明“矾精”中含有H+;检验“矾精”中含有SO42-的方法是__。
(2)某工厂计划用绿矾焙烧工艺生产高纯度铁红(Fe2O3)160kg,计算理论上所需绿矾的质量,写出计算过程。___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com