
【题目】下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧耗O2的量不变的是
A.甲烷、甲醇、甲醛;B.乙炔、苯、1,3-丁二烯
C.丙烯、2-丁烯、环已烷D.乙醇、乙烯、丙烯酸(CH2=CH-COOH)
【答案】D
【解析】
1mol有机物CxHyOz完全燃烧耗氧量n(O2)=(x+![]() -
-![]() )mol据此进行分析。
)mol据此进行分析。
假设混合物的物质的量为1mol,采用极值法进行
A.CH4的耗氧量=(x+![]() -
-![]() )=1+1=2,甲醇的耗氧量(x+
)=1+1=2,甲醇的耗氧量(x+![]() -
-![]() )=1+1-0.5=1.5,甲醛的耗氧量(x+
)=1+1-0.5=1.5,甲醛的耗氧量(x+![]() -
-![]() )=1+0.5=0.5,三者(x+
)=1+0.5=0.5,三者(x+![]() -
-![]() )值不相等,故A错误;
)值不相等,故A错误;
B.乙炔的耗氧量(x+![]() -
-![]() )=2+0.5=2.5,苯的耗氧量(x+
)=2+0.5=2.5,苯的耗氧量(x+![]() -
-![]() )=6+1.5=7.5,1-3-丁二烯的耗氧量(x+
)=6+1.5=7.5,1-3-丁二烯的耗氧量(x+![]() -
-![]() )=4+1.5=5.5,三者(x+
)=4+1.5=5.5,三者(x+![]() -
-![]() )值不相等,故B错误;
)值不相等,故B错误;
C.丙烯的耗氧量(x+![]() -
-![]() )=3+1.5=4.5,2-丁烯的耗氧量(x+
)=3+1.5=4.5,2-丁烯的耗氧量(x+![]() -
-![]() )=4+2=6,环己烷的耗氧量(x+
)=4+2=6,环己烷的耗氧量(x+![]() -
-![]() )=6+3=9,三者(x+
)=6+3=9,三者(x+![]() -
-![]() )值不相等,故C错误;
)值不相等,故C错误;
D.乙醇的耗氧量(x+![]() -
-![]() )=2+1.5-0.5=3,乙烯的耗氧量(x+
)=2+1.5-0.5=3,乙烯的耗氧量(x+![]() -
-![]() )=1+2=3,丙烯酸的耗氧量(x+
)=1+2=3,丙烯酸的耗氧量(x+![]() -
-![]() )=3+1-1=3,三者(x+
)=3+1-1=3,三者(x+![]() -
-![]() )值相等,故D正确;
)值相等,故D正确;
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族,A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称:A_______B________C________D_______E______
(2)用电子式表示离子化合物A2B的形成过程:_____________________
(3)写出下列物质的化学式、电子式或结构式:
①D元素形成的单质的结构式___________
②E和B形成化合物的电子式___________、___________
③A、B、E形成的化合物的化学式为________
④D、E形成的化合物空间结构型为________形_________性分子
⑤D、C、E形成的化合物的化学式为____________
⑥D、E形成的化合物为______化合物,(填“离子”或“共价”)包含的化学键为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a。已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
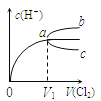
A.将饱和氯水加水稀释,溶液中c(H+)变化如曲线b
B.将饱和氯水降低温度,溶液中c(H+)变化如曲线c
C.在饱和氯水中加入NaOH使pH>7,所得溶液中存在下列关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(ClO-)
D.在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:2M+O2+2H2O=2M(OH)2。
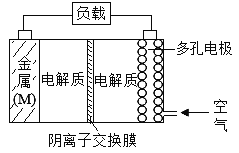
(已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能)下列说法正确的是
A.电解质中的阴离子向多孔电极移动
B.比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
C.空气电池放电过程的负极反应式2M-4e-+4OH-=2M(OH)2
D.当外电路中转移4mol电子时,多孔电极需要通入空气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有 PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
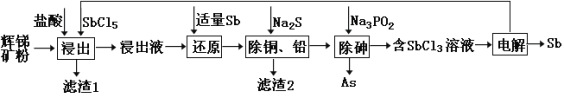
已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于或等于1.0×10-5mol/L时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________。
(3)该生产流程能实现(填化学式)的循环利用 __________。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______。
所加Na2S也不宜过多,其原因为______________。
(5)“除砷”时有H3PO3生成,该反应的离子方程式为__________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为___,M在元素周期表中的位置为___。
(2)X与Y按原子个数比1∶1构成的物质的电子式为___,所含化学键类型___。
(3)X+、Y2-、M2-离子半径大小顺序为___。
(4)将YM2通入FeCl3溶液中的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如图:

请回答下列问题:
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为__。
(2)溶液A中溶质除NaOH外,还有__。
(3)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有__(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是__。
③“钴渣”中LiCoO2溶解时的离子方程式为__。
(4)在“滤液1”中加入20﹪Na2CO3溶液,目的是__;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是__。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热。使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
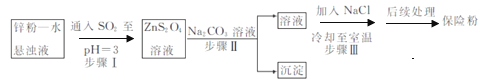
①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
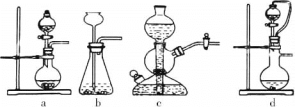
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业、上常用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及铁红,其生产流程如图:
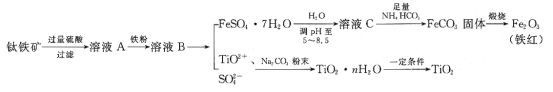
已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:
(1)钛铁矿用硫酸溶解时,过滤所得滤渣的成分是__(填化学式)。
(2)从溶液B中得到FeSO4·7H2O晶体的操作是__、过滤、洗涤、干燥。
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是__。
(4)煅烧FeCO3,发生反应的化学方程式是__。
(5)流程中加入Na2CO3粉末得到固体TiO2·nH2O。请结合TiO2+的水解平衡原理解释其原因:__。
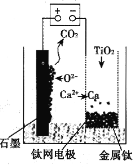
(6)用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制取金属钛。阳极反应式是__,反应过程中CaO的物质的量__(填“减小”“不变”或“增大”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com