
【题目】金属(M)-空气电池具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:2M+O2+2H2O=2M(OH)2。
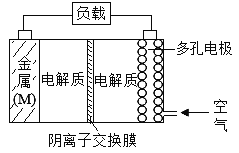
(已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能)下列说法正确的是
A.电解质中的阴离子向多孔电极移动
B.比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
C.空气电池放电过程的负极反应式2M-4e-+4OH-=2M(OH)2
D.当外电路中转移4mol电子时,多孔电极需要通入空气22.4L(标准状况)
【答案】C
【解析】
A.原电池中阴离子应该向负极移动;
B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,即单位质量的电极材料失去电子的物质的量越多,则得到的电能越多;
C.负极M失电子和OH反应生成M(OH)2;
D.由正极电极反应式O2+2H2O+4e=4OH有O2~4OH~4e,当外电路中转移4mol电子时,消耗氧气1mol,但空气中氧气只占体积分数21%,据此计算判断。
A.原电池中阴离子应该向负极移动,金属M为负极,所以电解质中的阴离子向金属M方向移动,故A错误;
B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这三种金属转移电子物质的量分别为![]() ×2mol=
×2mol=![]() mol、
mol、![]() ×3mol=
×3mol=![]() mol、
mol、![]() ×2mol=
×2mol=![]() mol,所以Al空气电池的理论比能量最高,故B错误;
mol,所以Al空气电池的理论比能量最高,故B错误;
C.负极M失电子和OH反应生成M(OH)2,则正极反应式为2M-4e-+4OH-=2M(OH)2,故C正确;
D.由正极电极反应式O2+2H2O+4e=4OH有O2~4OH~4e,当外电路中转移4mol电子时,消耗氧气1mol,即22.4L(标准状况下),但空气中氧气只占体积分数21%,所以空气不止22.4L,故D错误;
故答案选C。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质的分类正确的是( )
A.同位素: H2 D2 T2B.非电解质: NH3、C2H5OH
C.非极性分子:C60、CO2、CH2Cl2D.同系物: ![]() -OH、CH3-
-OH、CH3-![]() -OH、CH3-
-OH、CH3-![]() -CH2OH
-CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图,下列叙述正确的是( )
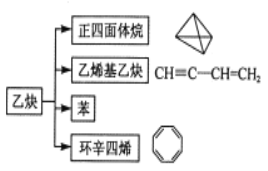
A.正四面体烷的二氯代物有2种
B.等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不相同
C.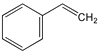 与环辛四烯均能使溴的CCl4溶液褪色
与环辛四烯均能使溴的CCl4溶液褪色
D.乙炔生成乙烯基乙炔是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个体积均为0.5L的密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:

下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.1mol·L-1·min-1
B.x=1
C.由图可知:T1<T2,且该反应为吸热反应
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L的Na2CO3溶液中,下列关系式正确的是( )
A.c(Na+)=2c(CO32-)B.c(H+)>c(OH-)
C.c(CO32-)+c(HCO3-)=0.1mol/LD.c(HCO3-)<c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国的铀工业自20世纪50年代兴起,现已形成完整的和具有相当规模的科研和工业生产体系。铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4〔UO2(CO3)3〕等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。
①基态氟原子的价电子排布图为_____________;
②金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______;
③UF4用Mg或Ca还原时,其氧化产物是MgF2或CaF2,已知MgF2的熔点高于CaF2,其原因是_________________。
(2)已知:(NH4)4〔UO2(CO3)3〕![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①(NH4)4〔UO2(CO3)3〕存在的微粒间作用力是_________;
a. 离子键 b. 共价键 c. 配位键 d. 金属键
②NH4+的空间构型为______,与NH4+等电子体的分子或离子有_____(写一种);
③CO32-中碳原子杂化轨道类型为_________;
(3)UO2的晶胞结构如图所示:

①晶胞中U原子位于面心和顶点,氧原子填充在U原子堆积形成的空隙中,在该空隙中氧原子堆积形成的立体的空间构型为___________(填“立方体”、“四面体”、“八面体”);
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为__________g·cm-3。(列出含a算式即可。用NA表示阿伏加德罗常数的值。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧耗O2的量不变的是
A.甲烷、甲醇、甲醛;B.乙炔、苯、1,3-丁二烯
C.丙烯、2-丁烯、环已烷D.乙醇、乙烯、丙烯酸(CH2=CH-COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.热化学方程式C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,可知乙炔的燃烧热为1256kJ·mol-1
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,可知乙炔的燃烧热为1256kJ·mol-1
C.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
D.稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,生成H2的体积为112mL
C.常温常压下,3.2 g O2所含的原子数为0.2NA
D.标准状况下,2.24 LH2O含有的H2O分子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com