
【题目】下列各组物质的分类正确的是( )
A.同位素: H2 D2 T2B.非电解质: NH3、C2H5OH
C.非极性分子:C60、CO2、CH2Cl2D.同系物: ![]() -OH、CH3-
-OH、CH3-![]() -OH、CH3-
-OH、CH3-![]() -CH2OH
-CH2OH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示:
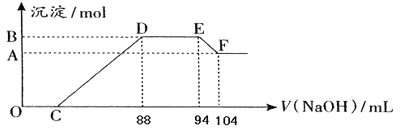
(1)B与A的差值为________mol。
(2)C点对应的溶液体积为________mL。
(3)原硝酸溶液中含硝酸的物质的量为________mol。
(4)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为_______________。
(5)写出铝与该浓度硝酸反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得浓度均为0.5 mol. L-1的Pb(CH3COO)2溶液的导电性明显弱于Pb(NO3)2溶液,又知PbS是不溶于水及稀酸的黑色沉淀,下列离子方程式书写错误的是
A.Pb(NO3)2溶液与CH3COONa溶液混合:Pb2+ +2CH3COO-=Pb(CH3COO)2
B.Pb(NO3)2溶液与K2S溶液混合:Pb2++S2-=PbS↓
C.Pb(CH3COO)2溶液与K2S溶液混合:Pb(CH3COO)2+S2- =PbS↓+ 2CH3COO-
D.Pb(CH3COO)2在水中电离: Pb(CH3COO)2=Pb2+ +2CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.常温下,18gH2O中电子数均为10NA
B.标准状况下,2molSO2和1molO2充分反应生成SO2的数目为2NA
C.常温下,1L1mol·L-1Na2CO3溶液中,阴离子数目大于NA
D.1molCl2与FeCl2溶液完全与反应,转移电子的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。

(1)上表中,反应速率最快的是_______;
(2)实验3、4预期可得出的结论是_______;
(3)设计实验2、3的目的是_________;
(4)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中(容积为5L),充入氨气和氧气,使其物质的量之比为1∶2,并发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),此反应在一定条件下进行2min后,测得NH3的物质的量为2mol,NH3的转化率为20%。
4NO(g)+6H2O(g),此反应在一定条件下进行2min后,测得NH3的物质的量为2mol,NH3的转化率为20%。
(1)以NO的浓度变化表示该反应的平均反应速率是________。
(2)O2在2min时的浓度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族,A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称:A_______B________C________D_______E______
(2)用电子式表示离子化合物A2B的形成过程:_____________________
(3)写出下列物质的化学式、电子式或结构式:
①D元素形成的单质的结构式___________
②E和B形成化合物的电子式___________、___________
③A、B、E形成的化合物的化学式为________
④D、E形成的化合物空间结构型为________形_________性分子
⑤D、C、E形成的化合物的化学式为____________
⑥D、E形成的化合物为______化合物,(填“离子”或“共价”)包含的化学键为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:2M+O2+2H2O=2M(OH)2。
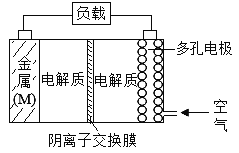
(已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能)下列说法正确的是
A.电解质中的阴离子向多孔电极移动
B.比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
C.空气电池放电过程的负极反应式2M-4e-+4OH-=2M(OH)2
D.当外电路中转移4mol电子时,多孔电极需要通入空气22.4L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com