
【题目】NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.常温下,18gH2O中电子数均为10NA
B.标准状况下,2molSO2和1molO2充分反应生成SO2的数目为2NA
C.常温下,1L1mol·L-1Na2CO3溶液中,阴离子数目大于NA
D.1molCl2与FeCl2溶液完全与反应,转移电子的数目为2NA
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
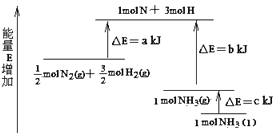
A.N2(g)+3H2(g)=2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) △H=2(b-a)kJ/mol
C.1/2 N2(g)+3/2H2(g)=NH3(l) △H=(b+c-a)kJ/mol
D.1/2 N2(g)+3/2H2(g)=NH3(g) △H=(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________。
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_______。
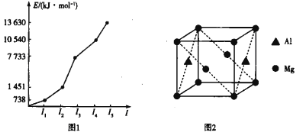
(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____。
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____个镁原子最近且等距离。
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:
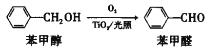
①苯甲醇中C原子杂化类型是__________。
②苯甲醇的沸点高于苯甲醛,其原因是__________。
(6)钛晶体有两种品胞,如图所示。
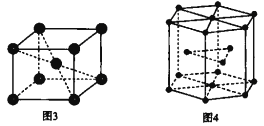
①如图3所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______mol—1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取40mL的0.50mol·L-1盐酸与40mL的0.55mol·L-1NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式__。
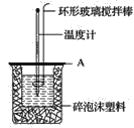
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是__。
(3)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,实验时还需测量的数据有(填字母)__。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前NaOH溶液的温度
D.反应前NaOH溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH | ||
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4mL 0.1mol·L-1 K2Cr2O7溶液,再加数滴1mol·L-1 NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1mol·L-1 HNO3,观察溶液颜色变化,并和另一份做对比_____。
实验现象 | 实验结论 | |
实验1 | ||
实验2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类正确的是( )
A.同位素: H2 D2 T2B.非电解质: NH3、C2H5OH
C.非极性分子:C60、CO2、CH2Cl2D.同系物: ![]() -OH、CH3-
-OH、CH3-![]() -OH、CH3-
-OH、CH3-![]() -CH2OH
-CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的分子式为C6H12N4,分子中每个N原子分别与三个C原子键合,而每个C原子分别与两个N原子键合。分子中没有C=C双键和C-C单键。试写出该有机物的结构简式___;该分子中有___个六元环;每个六元环占有___个氮原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个体积均为0.5L的密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:

下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.1mol·L-1·min-1
B.x=1
C.由图可知:T1<T2,且该反应为吸热反应
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com