
【题目】实验测得浓度均为0.5 mol. L-1的Pb(CH3COO)2溶液的导电性明显弱于Pb(NO3)2溶液,又知PbS是不溶于水及稀酸的黑色沉淀,下列离子方程式书写错误的是
A.Pb(NO3)2溶液与CH3COONa溶液混合:Pb2+ +2CH3COO-=Pb(CH3COO)2
B.Pb(NO3)2溶液与K2S溶液混合:Pb2++S2-=PbS↓
C.Pb(CH3COO)2溶液与K2S溶液混合:Pb(CH3COO)2+S2- =PbS↓+ 2CH3COO-
D.Pb(CH3COO)2在水中电离: Pb(CH3COO)2=Pb2+ +2CH3COO-
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热。下列说法正确的是

A.如图条件下实验过程中没有热量损失
B.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,通过测定反应过程中所放出的热量相等
C.图中实验装置缺少环形玻璃搅拌棒
D.烧杯间填满碎纸条的作用是固定小烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:25℃时,CaCO3的Ksp=2.8×10-9,现将Na2CO3浓度为2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A. 2.8×10-2mol·L-1 B. 5.6×10-5mol·L-1
C. 2.8×l0-5 mol·L-1 D. 1.4×l0-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
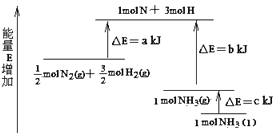
A.N2(g)+3H2(g)=2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) △H=2(b-a)kJ/mol
C.1/2 N2(g)+3/2H2(g)=NH3(l) △H=(b+c-a)kJ/mol
D.1/2 N2(g)+3/2H2(g)=NH3(g) △H=(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题涉及部分铜及其化合物的相关结构问题的考查,请回答下列问题。
(1)写出基态Cu2+的核外电子排布式:________。Cu的同周期元素中,与铜原子最外层电子数相等的元素原子还有___________(用元素符号表示)。
(2)从原子结构角度分析高温Cu2O比CuO稳定的原因是___________。
(3)[Cu(NH3)2]Ac可用于合成氨工业中的铜洗工序,除去进人合成塔前混合气中的CO(CO能使催化剂中毒)。
①Ac表示CH3COO-,Ac中碳原子的杂化方式为________。
②[Cu(NH3)2]Ac能够结合CO的原因是________。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
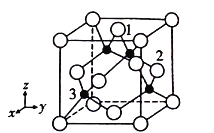
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于________填(“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(![]() ,
,![]() ,1),则原子2和3的坐标分别为___________、__________。
,1),则原子2和3的坐标分别为___________、__________。
③已知该晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________。
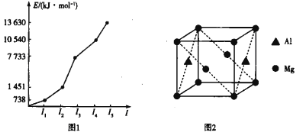
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_______。
(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____。
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____个镁原子最近且等距离。
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:
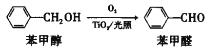
①苯甲醇中C原子杂化类型是__________。
②苯甲醇的沸点高于苯甲醛,其原因是__________。
(6)钛晶体有两种品胞,如图所示。
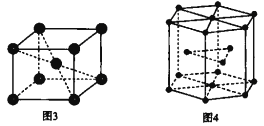
①如图3所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______mol—1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取40mL的0.50mol·L-1盐酸与40mL的0.55mol·L-1NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式__。
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是__。
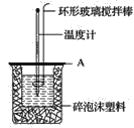
(3)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,实验时还需测量的数据有(填字母)__。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前NaOH溶液的温度
D.反应前NaOH溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH | ||
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类正确的是( )
A.同位素: H2 D2 T2B.非电解质: NH3、C2H5OH
C.非极性分子:C60、CO2、CH2Cl2D.同系物: ![]() -OH、CH3-
-OH、CH3-![]() -OH、CH3-
-OH、CH3-![]() -CH2OH
-CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图,下列叙述正确的是( )
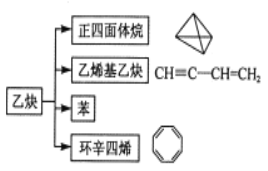
A.正四面体烷的二氯代物有2种
B.等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不相同
C.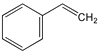 与环辛四烯均能使溴的CCl4溶液褪色
与环辛四烯均能使溴的CCl4溶液褪色
D.乙炔生成乙烯基乙炔是取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com