
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
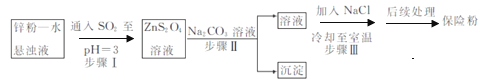
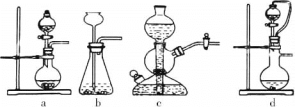
①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
【答案】2Na2S2O4+O2=2Na2SO3+2SO2 ad 增大锌粉的表面积,加快反应速率 ZnS2O4+Na2CO3=Na2S2O4+ZnCO3↓ 除去晶体表面的水分,并减少Na2S2O4的溶解损失 HCOONa+NaOH+2SO2=Na2S2O4+CO2+H2O 0.256
【解析】
(1)根据已知的反应物、生成物,结合电子守恒,书写反应方程式;
(2)①结合物质的存在状态及反应条件,判断使用的装置;
②根据化学反应速率影响因素分析,结合复分解反应规律书写反应方程式;
③结合物质的溶解性分析;
(3)根据题干信息,书写反应方程式;
(4)根据氧化还原反应中电子转移数目相等计算。
(1) Na2S2O4与O2生成Na2SO3和SO2,反应方程式为2Na2S2O4+O2=2Na2SO3+2SO2;
(2)①浓硫酸与Na2SO3发生复分解反应产生Na2SO4、SO2、H2O,反应方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,
a.反应不需要加热,Na2SO3是细小晶体,通过控制分液漏斗的活塞控制反应速率,装置a合理;
b.不能控制反应速率,且浓硫酸具有吸水性,长颈漏斗容易导致浓硫酸稀释,b不合理;
c.浓硫酸与盐的反应放出大量的热,会导致集气瓶炸裂,c不合理;
d.通过控制分液漏斗的活塞控制反应速率,上下联通的导气管会使浓硫酸上下气体压强一致,便于浓硫酸顺利滴下,装置d合理;
故合理选项是ad;
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是增大锌粉的表面积,加快反应速率。根据流程图可知步骤Ⅱ中发生复分解反应的化学方程式为ZnS2O4+Na2CO3=Na2S2O4+ZnCO3↓;
③Na2S2O4易溶于水,难溶于乙醇,用乙醇洗涤,既能除去晶体表面的水分,并减少Na2S2O4的溶解损失;
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙 醇水溶液液中,然后通入SO2发生反应,产生Na2S2O4,同时有CO2气体放出和水生成,总反应的化学方程式是HCOONa+NaOH+2SO2=Na2S2O4+CO2+H2O。
(4)根据氧化还原反应中电子转移数目相等可知两种物质的反应关系为:2K3[Fe(CN)6] ~~Na2S2O4,n{K3[Fe(CN)6]}=0.02mol/L×0.01L=2×10-4mol,则n(Na2S2O4)=1×10-4mol,溶液的体积是50mL=0.05L,所以c(Na2S2O4)= 1×10-4mol÷0.05L=2×10-3mol/L,根据S元素守恒,该样品中Na2S2O4的含量以SO2计为:2×10-3mol/L ×2×64g/mol=0.256gL-1。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图,下列叙述正确的是( )
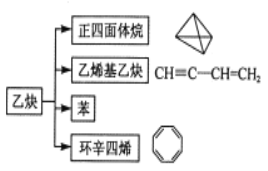
A.正四面体烷的二氯代物有2种
B.等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不相同
C.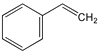 与环辛四烯均能使溴的CCl4溶液褪色
与环辛四烯均能使溴的CCl4溶液褪色
D.乙炔生成乙烯基乙炔是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧耗O2的量不变的是
A.甲烷、甲醇、甲醛;B.乙炔、苯、1,3-丁二烯
C.丙烯、2-丁烯、环已烷D.乙醇、乙烯、丙烯酸(CH2=CH-COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.热化学方程式C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,可知乙炔的燃烧热为1256kJ·mol-1
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,可知乙炔的燃烧热为1256kJ·mol-1
C.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
D.稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(III)和V(IV)形式存在,由含矾石煤提钒的一种工艺流程如图所示:
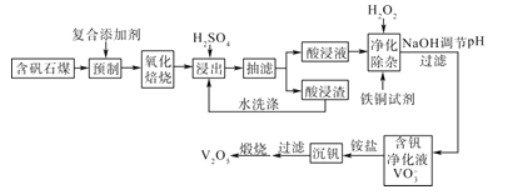
已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
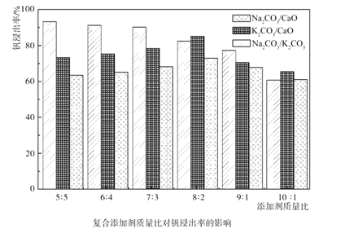
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__,最佳添加比例为__。
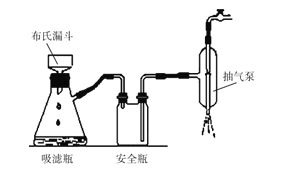
(2)如图为“抽滤”实验原理装置图,"抽滤”时抽气泵的作用是__;“酸浸渣”经“水洗涤”返回“浸出”的目的是__。
(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为__。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__。
(4)“沉钒”的离子反应方程式为___。
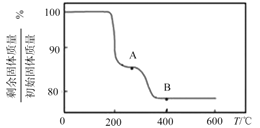
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%)。则A点对应物质的化学式为__,B点对应的物质为V2O5,则B点坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
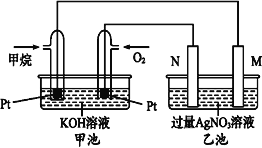
(1)M电极的材料是_____, 其电极反应式为:_______。N的电极名称是_____,其电极反应式为:_____。
(2)通入O2的铂电极的电极反应式为:________。
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为_____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,生成H2的体积为112mL
C.常温常压下,3.2 g O2所含的原子数为0.2NA
D.标准状况下,2.24 LH2O含有的H2O分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=-99 kJ·![]() 。请回答下列问题:
。请回答下列问题:
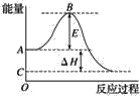
(1)图中A、C分别表示__,E的大小对该反应的反应热__(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点__(填“升高”或“降低”),ΔH__(填“变大”“变小”或“不变”)。
(2)图中ΔH=__kJ·![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com