
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=-99 kJ·![]() 。请回答下列问题:
。请回答下列问题:
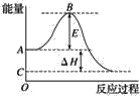
(1)图中A、C分别表示__,E的大小对该反应的反应热__(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点__(填“升高”或“降低”),ΔH__(填“变大”“变小”或“不变”)。
(2)图中ΔH=__kJ·![]() 。
。
【答案】反应物总能量;生成物总能量 无 降低 不变 -198
【解析】
(1)反应物总能量大于生成物总能量,为放热反应,加入催化剂,活化能减小,反应热不变;
(2)根据反应2SO2(g)+O2(g)=2SO3(g)结合1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1计算反应热。
(1)图中A、C分别表示反应物总能量、生成物总能量。B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关。加入催化剂能降低反应的活化能,加快化学反应速率,但不改变ΔH。
(2)因1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·![]() ,所以2 mol SO2(g)氧化为2 mol SO3的ΔH=-198 kJ·
,所以2 mol SO2(g)氧化为2 mol SO3的ΔH=-198 kJ·![]() ,则2SO2(g)+O2(g)=2SO3(g)ΔH=-198 kJ·
,则2SO2(g)+O2(g)=2SO3(g)ΔH=-198 kJ·![]() 。
。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
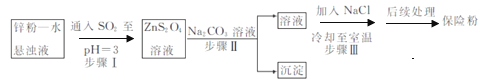
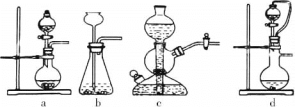
①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
查看答案和解析>>
科目:高中化学 来源: 题型:
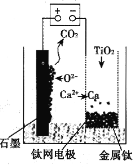
【题目】工业、上常用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及铁红,其生产流程如图:
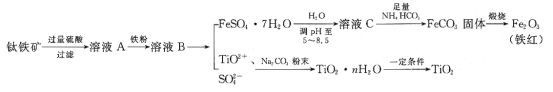
已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:
(1)钛铁矿用硫酸溶解时,过滤所得滤渣的成分是__(填化学式)。
(2)从溶液B中得到FeSO4·7H2O晶体的操作是__、过滤、洗涤、干燥。
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是__。
(4)煅烧FeCO3,发生反应的化学方程式是__。
(5)流程中加入Na2CO3粉末得到固体TiO2·nH2O。请结合TiO2+的水解平衡原理解释其原因:__。
(6)用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制取金属钛。阳极反应式是__,反应过程中CaO的物质的量__(填“减小”“不变”或“增大”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)ΔH=﹣1367.0 kJ·![]() (燃烧热)
(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) ΔH=+57.3 kJ·![]() (中和热)
(中和热)
C.S(s)+O2(g)=SO2(g) ΔH=﹣269.8 kJ·![]() (反应热)
(反应热)
D.2NO2=O2+2NO ΔH=+116.2 kJ·![]() (反应热)
(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在800 mL的大烧杯中放入碎纸屑把盛有50 mL 0.50 mol·L-1盐酸的100 mL烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑料板做成大烧杯盖,通过盖子插入一根环形玻璃搅拌棒和一支温度计,测定溶液的温度。迅速往盐酸中加入 50 mL 0.55 mol·L-1NaOH溶液,盖好盖子,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装有反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。
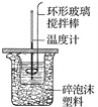
(1)烧杯间填满碎纸屑的作用是____________。
(2)要重复进行三次实验的目的是_____________。
(3)烧杯若不盖泡沫塑料板,求得的中和热数值将________(填“偏大”“偏小”或“无影响”)。
(4)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1NaOH溶液进行上述反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),理由是_______。
(5)三次实验测得的数据中,起始时盐酸与NaOH溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.5 ℃。则最终代入计算式的温度差的平均值为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
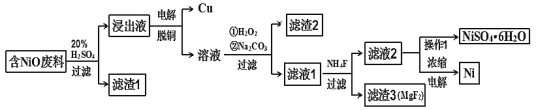
已知:有关金属离子生成氢氧化物沉淀所需的pH如图:

(1)滤渣1的主要成分为____。
(2)①用离子方程式解释加入H2O2的作用____。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为____。
(3)从滤液2中获得NiSO4·6H2O的实验操作是____、过滤、洗涤、干燥。
(4)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如图:
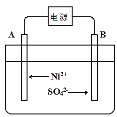
①B极附近pH会____(填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因:____。
②一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计如下实验。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100℃时开始升华,157℃时大量升华并开始分解;草酸蒸气在低温下迅速冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:

①装置的连接顺序为:A→D→____→____→F→E→C→G。
②装置中冰水混合物的作用是____。
③整套装置存在不合理之处为____。
Ⅱ.乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol/L的草酸溶液480mL。
(2)配制该溶液需要草酸晶体____g。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是____。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1mol/L草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
D.测定草酸钠溶液的pH
(4)该小组同学将0.1mol/L草酸溶液和0.1mol/L的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为____。
Ⅲ.乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-====4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2====2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com