
【题目】下列操作、现象和结论均正确的是( )
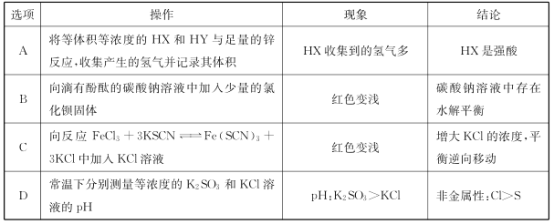
A.AB.BC.CD.D
【答案】B
【解析】
A.等体积等浓度的HX和HY,酸的物质的量相同;
B.钡离子与碳酸根离子反应生成沉淀,使水解平衡逆向移动;
C.加入KCl,对平衡移动无影响,但溶液体积增大;
D.盐溶液的pH越大,对应酸的酸性越弱,但盐酸为无氧酸。
A.等体积等浓度的HX和HY,酸的物质的量相同,与足量Zn反应生成氢气体积相同,故A错误;
B.钡离子与碳酸根离子反应生成沉淀,使水解平衡逆向移动,红色变浅,故B正确;
C.加入KCl,KCl溶液中的K+、Cl-对平衡移动无影响,但溶液体积增大,则红色变浅,故C错误;
D.盐溶液的pH越大,对应酸的酸性越弱,但盐酸为无氧酸,不能比较非金属性,故D错误;
故选 B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质 | X | Y | Z |
初始浓度/ | 0.1 | 0.2 | 0 |
平衡浓度/ | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、理象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向某溶液中加入NaOH 溶液,并用湿润的红色石蕊试纸检验 | 试纸没有变蓝 | 原溶液中没有有NH4+ |
B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 原溶液中一定有Fe2+ |
D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,总反应为2Na+xS![]() Na2Sx,其反应原理如图所示。下列叙述正确的是( )
Na2Sx,其反应原理如图所示。下列叙述正确的是( )
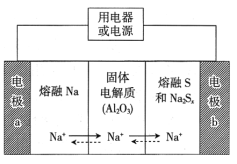
A.放电时,电极a为正极
B.放电时,内电路中Na+的移动方向为从b到a
C.充电时,电极b的反应式为Sx2--2e-=xS
D.充电时,Na+在电极b上获得电子,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示的装置对能量变化情况进行研究。当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升。不符合要求的X、Y可能是( )
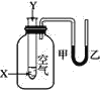
A.X是水,Y是浓硫酸
B.X是盐酸,Y是氢氧化钠溶液
C.X是硝酸铵固体,Y是水
D.X是铝粉,Y是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
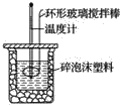
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
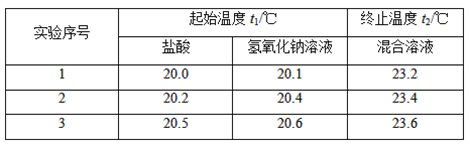
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(3)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 g炭粉燃烧所得气体中,CO占![]() 体积、CO2占
体积、CO2占![]() 体积,且
体积,且
C(s)+![]() O2(g)=CO(g) ΔH=-110.35 kJ·mol-1
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-392.92 kJ·mol-1
与这些炭完全燃烧相比较,损失的热量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×![]()
![]() ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.将1 mol ![]() 转化为
转化为![]() 胶体,
胶体,![]() 胶粒数小于6.02×
胶粒数小于6.02×![]()
B.标准状况下,22.4 L![]() 中含有溴原子数约为2×6.02×
中含有溴原子数约为2×6.02×![]()
C.常温下,9.2 g ![]() 含有的分子数小于0.2×6.02×
含有的分子数小于0.2×6.02×![]()
D.25℃时,pH=12的![]() 溶液1 L所含
溶液1 L所含![]() 数约为6.02×
数约为6.02×![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温炼铜的反应之一为2CuFeS2+O2![]() Cu2S+2FeS+SO2。
Cu2S+2FeS+SO2。
(1)Cu+基态核外电子排布式为___________。
(2)Cu、Zn的第二电离能:I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(3)SO2分子中S原子的轨道杂化类型为________,分子的立体构型为________。
(4)[Cu(CH3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为________。
(5)Fe2+、Fe3+能与CN-络合,其结构如图所示。该离子可形成铁蓝钾盐,该钾盐的化学式为_________。
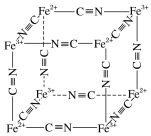
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com