
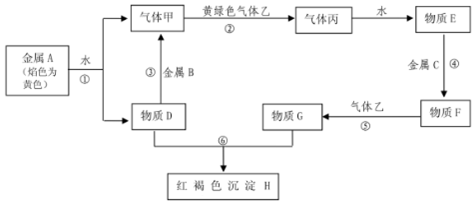
分析 金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{Cl_{2}}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题.
解答 解:(1)由以上分析可知F为FeCl2,丙为HCl,故答案为:FeCl2;HCl;
(2)反应⑤为氯化亚铁和氯气的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,反应⑥氯化铁和氢氧化钠的反应,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3OH-=Fe(OH)3↓;
(3)反应①为钠和水的反应,生成氢氧化钠和氢气,属于置换反应,故答案为:C;
(4)如亚铁离子变质,可生成铁离子,可加入KSCN溶液检验,溶液变为红色,说明变质,因铁离子和铁反应可生成亚铁离子,可用铁粉还原除杂,
故答案为:KSCN溶液;加入足量还原性铁粉,过滤.
点评 本题是考查物质推断与性质、常用化学用语,为高频考点,侧重考查学生的分析能力,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.4 mol/L | B. | c(X2)=0.2mol/L | ||
| C. | c(Y2)=0.4mol/L | D. | c(X2)+c(Y2)+c(Z)=0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na 和O2 | B. | NaOH 和 CO2 | C. | AlCl3 和氨水 | D. | Na2CO3 和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
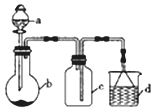
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 稀硝酸 | Cu | NO | H2O |
| B | 稀H2SO4 | CaCO3 | CO2 | NaOH溶液 |
| C | 浓氨水 | NaOH固体 | NH3 | H2O |

| 称量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 质量(g) | m1=5.4 | m2=8.2 | m3=7.4 | m4=7.2 | m5=7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23:24:27 | B. | 1:2:3 | C. | 6:3:2 | D. | 6:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏大 | |
| B. | NaCl溶液和CH3COONH4溶液均显中性且两溶液中水的电离程度相同 | |
| C. | 用pH试纸测定次氯酸钠溶液的pH | |
| D. | 除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com