
【题目】我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式如下:

这种材料可采用如图所示的合成路线
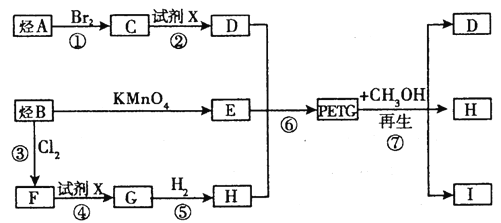
(1)![]()
(2)RCOORl+R2OH→RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
(1) ⑦的反应类型是________________。
(2) 写出I的结构简式:___________________。
(3) 合成时应控制的单体的物质的量:n(H)∶n(E)∶n (D)=____________(用m、n表示)。
(4) 写出反应②的化学方程式:______________________
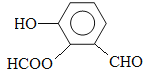
(5) 写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①该同分异构体的苯环上相邻的三个碳原子上都连有取代基。
②该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色。
______________、_________________、____________。
【答案】(1)取代反应
(2)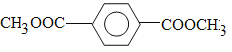 (3)n︰(m+n)︰m
(3)n︰(m+n)︰m
(4)CH2Br-CH2Br+2NaOH![]() 2NaBr+CH2OH-CH2OH
2NaBr+CH2OH-CH2OH
(5)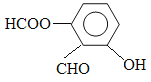 、
、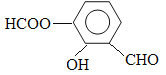 、
、
【解析】
考查有机物的合成。根据PETG的结构简式可知,该物质是缩聚产物,其单体分别是乙二醇、对二苯甲酸和![]() 。因为E是B的氧化产物,所以E是对二苯甲酸,则B是对二甲苯。反应③是取代反应,所以F的结构简式为
。因为E是B的氧化产物,所以E是对二苯甲酸,则B是对二甲苯。反应③是取代反应,所以F的结构简式为![]() ,F通过水解反应生成G,则G是对二苯甲醇,G通过加成反应生成H,则H的结构简式为
,F通过水解反应生成G,则G是对二苯甲醇,G通过加成反应生成H,则H的结构简式为![]() ,所以D是乙二醇。因此A是乙烯,和单质溴发生加成反应生成C,则C的结构简式为CH2Br-CH2Br,C再经过水解反应即生成乙二醇D。
,所以D是乙二醇。因此A是乙烯,和单质溴发生加成反应生成C,则C的结构简式为CH2Br-CH2Br,C再经过水解反应即生成乙二醇D。
(1)⑦是取代反应
(2)根据抑制信息(2)可知I的结构简式为![]() 。
。
(3)根据原子守恒可知:n(H):n(E):n (D)=n︰(m+n)︰m。
(4)反应②是卤代烃的水解反应,方程式为CH2Br-CH2Br+2NaOH![]() 2NaBr+CH2OH-CH2OH。
2NaBr+CH2OH-CH2OH。
(5)能发生银镜反应,说明含有醛基。能水解,说明含有酯基。和氯化铁发生显色反应,说明含有酚羟基,所以这三个取代基为-OH、-CHO、HCOO-。其位置共有3种,所以有3种同分异构体。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中不正确的是
A. 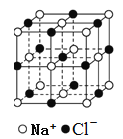 在NaCl晶体中,距Na+最近的Cl-形成正八面体
在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 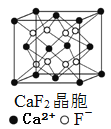 在CaF2晶体中,每个晶胞平均占有4个Ca2+
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.  在石墨晶体中,每个环上平均占有3个碳原子
在石墨晶体中,每个环上平均占有3个碳原子
D. 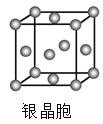 在银晶体中,银原子的配位数为12
在银晶体中,银原子的配位数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 顺-2-丁烯和反-2-丁烯的加氢产物不同
B. 用重结晶的方法提纯苯甲酸时应趁热过滤
C. 邻二甲苯只有一种结构能说明苯分子的结构中,碳碳键不是单、双键交替的事实
D.  的结构中含有酯基
的结构中含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z可用于防治骨质疏松,可通过X、Y经两步转化得到Z。下列说法正确的是( )
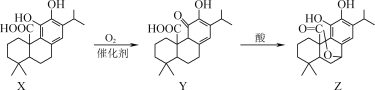
A. X、Y、Z都属于芳香族化合物
B. Y分子中含有3个手性碳原子
C. X、Y、Z与浓溴水反应最多消耗1molBr2
D. 1molZ与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(17分)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
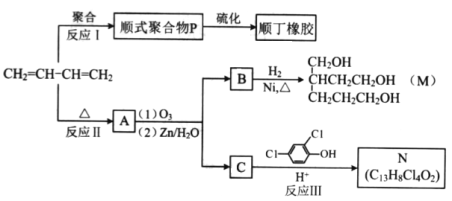
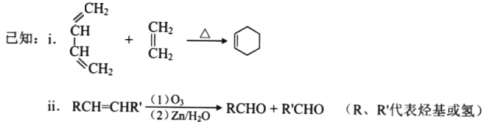
(1)CH2=CH-CH=CH2的名称是_______;
(2)反应I的反应类型是(选填字母)_______;
a.加聚反应 b.缩聚反应
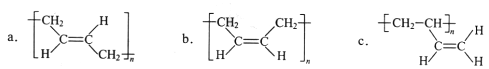
(3)顺式聚合物P的结构式是(选填字母)_______;
(4)A的相对分子质量为108.
①反应II的化学方程式是_____________________
②1molB完全转化为M所消耗的H2的质量是______g。
(5)反应III的化学方程式是______________________________。
(6)A的某些同分异构体在相同反应条件下也能生成B和C,写出其中一种同分异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)![]() Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
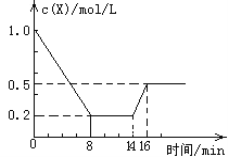
A. 0~8min用Y表示的该反应的速率为0.1mol·L-1·min-1
B. 8min时达到平衡,该反应的平衡常数为K=0.5
C. 14min时,改变的反应条件是降低了体系的温度
D. 16min时的正反应速率,比8min时的正反应速率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
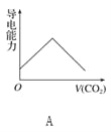
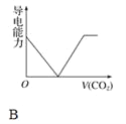

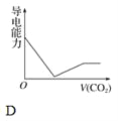
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一]
(1)常温下,可以用铁质容器盛放冷的浓硫酸,其原因是__;
(2)称取碳素钢6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学队为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用___(选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此推知气体Y中SO2的体积分数为__。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中除SO2外还可能含有Q1和Q2两种气体,其中Q1气体,存标准状况下密度为0.0893g/L。为此设计了下列探究实验装置(假设有关气体完全反应)。
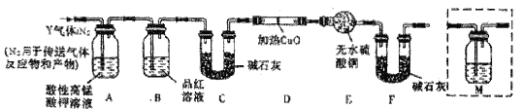
(3)装置B中试剂的作用是___。
(4)分析Y气体中的Q2气体是如何生成的___(用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加M于____(填序号)。
A.A之前 B.A—B间 C.B—C间 D.C—D间
(6)确认Q1气体存在的实验现象是____。
[探究三]如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
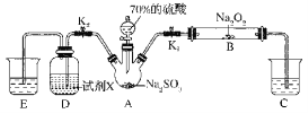
(7)下列有关说法不正确的是___
A.关闭K2,打开Kl,滴加硫酸,则装置B中每消耗1molNa2O2,转移电子数为2NA
B.关闭Kl,打丌K2,试剂X是酸性KmnO4或FeCl3溶液,均可证明SO2有还原性
C.为防止环境污染,装置C和E中的试剂均取用NaOH溶液
D.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com