
【题目】有关晶体的结构如下图所示,下列说法中不正确的是
A. 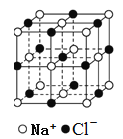 在NaCl晶体中,距Na+最近的Cl-形成正八面体
在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 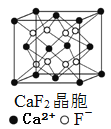 在CaF2晶体中,每个晶胞平均占有4个Ca2+
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.  在石墨晶体中,每个环上平均占有3个碳原子
在石墨晶体中,每个环上平均占有3个碳原子
D. 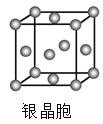 在银晶体中,银原子的配位数为12
在银晶体中,银原子的配位数为12
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于![]() 的说法错误的是
的说法错误的是
A.属于金属元素B.![]() 和
和![]() 是钇元素的两种同位素
是钇元素的两种同位素
C.原子的核外电子数为39D.质子数与中子数之差为50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近段时间,全国范围内的雾霾天气严重影响了人们的身体健康,环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题
请回答下列问题
(1)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH。
已知:①N2(g)+O2(g)===2NO(g) △H=+180.5kJ·mol-1;
②2H2(g)+ O 2(g)===2H2O(1) △H=-571.6kJ·mol-1;
③H2O(g)===H2O(1) △H=-44kJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:______________________。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。在密闭容器中充有10 mol CO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___________0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___________,此时容器的体积为___________L。
CH3OH(g)。在密闭容器中充有10 mol CO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___________0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___________,此时容器的体积为___________L。

(3)工业上采用加压条件下,在含冷却装置的吸收塔中,以去离子水为吸收剂吸收NO,得到40%的硝酸。原理如下:
2NO(g)+O2(g)![]() 2NO2(g) △H=-114 kJ/mol
2NO2(g) △H=-114 kJ/mol
3NO2(g)+H2O(l)![]() 2 HNO3(aq)+ NO(g) △H=-69 92 kJ/molo
2 HNO3(aq)+ NO(g) △H=-69 92 kJ/molo
采用降温操作的两个原因是_________________________________。
(4)利用电解原理也可以处理工厂烟气。如图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则A为___________极(填“正”“负”“阴”或“阳”),电极反应式为______________________。Ⅹ溶液中溶质的成分为___________(填化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种实验装置的有关用法,其中正确的是
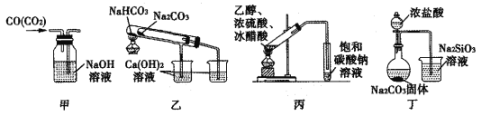
A.甲装置:可用来除去CO气体中的CO2气体
B.乙装置:可用来验证NaHCO3和Na2CO3的热稳定性
C.丙装置:可用来实验室制备乙酸乙酯
D.丁装置:可用来比较HC1、H2CO3和H2SiO3的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。(实验目的) 制取乙酸乙酯
(实验原理) 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。(装置设计) 甲、乙、丙三位同学分别设计了下列三套实验装置:
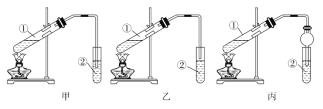
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是______(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是________________。
(实验步骤)
(1)按丙同学选择的装置组装仪器,在试管中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
(问题讨论)
a.步骤(1)安装好实验装置,加入样品前还应检查____________;
b.写出试管①发生反应的化学方程式(注明反应条件) _______________________;
c.试管②中饱和Na2CO3溶液的作用是_________________________;________(填“能”或“不能”)换成NaOH溶液,原因___________________;
d.从试管②中分离出乙酸乙酯的实验操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些元素的信息,其中有一种元素不在短周期。
元素A | 元素B | 元素C | 元素X | 元素Y |
单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π数目比为1:2 |
根据上述信息回答下列问题:
(1)写出X3的等电子体_____(写一个即可),基态Y原子核外电子所占据的最高能级的电子云形状为______。
(2)A元素在元素周期表中的___区,基态A原子的未成对电子有___个。
(3)B、C、X的简单离子半径由大到小的顺序为______(填离子符号)。
(4)HX与HY两种共价键中,键的极性较强的是____,键长较长的是____(X、Y用元素符号表示)。
(5)Y与碳元素形成的一种阴离子与Y2是等电子体,请写出该阴离子的电子式___。Y的常见氢化物易溶于水的主要原因是___。
(6)铂丝蘸取化合物CB在酒精灯上灼烧,火焰呈___色,显色原因是___(填序号)。
A.CB受热挥发 B.CB受热分解
C.C离子中电子跃迁 D.B离子中电子跃迁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是_____。

(2)H2SeO4比H2SeO3酸性强的原因:_________。
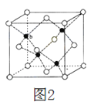
(3)ZnS在光导体材料、荧光体、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图2所示,其晶胞边长为a pm,密度为______gcm3。(用含a和NA的表达式填空)
II.氮及其化合物与人类生产、生活息息相关。化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。请回答下列问题:
(4)N4分子中的氮氮键的键角为____,1molN4分子中含有的氮氮键的数目为____。
(5)N4比P4的沸点____(填“高”或“低”),原因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式如下:

这种材料可采用如图所示的合成路线
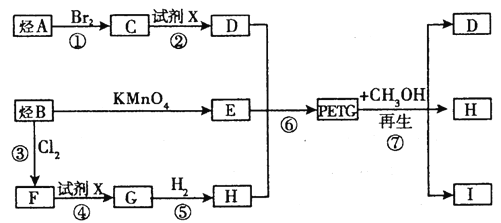
(1)![]()
(2)RCOORl+R2OH→RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
(1) ⑦的反应类型是________________。
(2) 写出I的结构简式:___________________。
(3) 合成时应控制的单体的物质的量:n(H)∶n(E)∶n (D)=____________(用m、n表示)。
(4) 写出反应②的化学方程式:______________________
(5) 写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①该同分异构体的苯环上相邻的三个碳原子上都连有取代基。
②该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色。
______________、_________________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )

A. Cu和浓硝酸 B. CaO和浓氨水
C. 大理石和稀盐酸 D. 高锰酸钾溶液和浓盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com