
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。(实验目的) 制取乙酸乙酯
(实验原理) 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。(装置设计) 甲、乙、丙三位同学分别设计了下列三套实验装置:
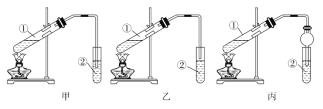
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是______(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是________________。
(实验步骤)
(1)按丙同学选择的装置组装仪器,在试管中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
(问题讨论)
a.步骤(1)安装好实验装置,加入样品前还应检查____________;
b.写出试管①发生反应的化学方程式(注明反应条件) _______________________;
c.试管②中饱和Na2CO3溶液的作用是_________________________;________(填“能”或“不能”)换成NaOH溶液,原因___________________;
d.从试管②中分离出乙酸乙酯的实验操作是________。
【答案】乙 能防止倒吸 装置的气密性 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 吸收乙醇,除去乙酸 降低乙酸乙酯的溶解度,使其分层析出 不能,若用NaOH溶液,则NaOH会使生成的乙酸乙酯又彻底水解,导致实验失败 分液
CH3COOC2H5+H2O 吸收乙醇,除去乙酸 降低乙酸乙酯的溶解度,使其分层析出 不能,若用NaOH溶液,则NaOH会使生成的乙酸乙酯又彻底水解,导致实验失败 分液
【解析】
乙醇和乙酸在浓硫酸环境下加热,生成乙酸乙酯,乙酸和乙醇有挥发性,收集乙酸乙酯时注意防倒吸,同时试管中加入的试剂为饱和碳酸钠溶液,溶解乙醇,吸收乙酸,降低乙酸乙酯在水中的溶解度。
作为实验室制取乙酸乙酯的装置,导管与液面有空隙,防止液体倒吸,较合理的是乙。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是能防止倒吸。
a.步骤(1)安装好实验装置,实验前即加入样品前,还应检查装置的气密性;
b.试管①发生乙酸和乙醇的取代反应,反应可逆,化学方程式CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
c.试管②中饱和Na2CO3溶液的作用是吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度,使其分层析出;不能换成NaOH溶液,原因为若用NaOH溶液,则NaOH会使生成的乙酸乙酯又彻底水解,导致实验失败;
d.乙酸乙酯不溶于水,从试管②中分离出乙酸乙酯的实验操作是分液。


科目:高中化学 来源: 题型:
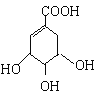
【题目】莽草酸合成治疗禽流感的药物—达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
(提示:环丁烷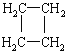 可简写成
可简写成![]() )
)
(1)A的分子式是_______
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)_____
(3)A与乙醇反应的化学方程式(有机物用结构简式表示)是_______
(4)17.4g A与足量碳酸氢钠溶液反应,计算生成二氧化碳的体积(标准状况)____L
(5)A在浓硫酸作用下加热可得到B(B的结构简式为![]() ),其反应类型是____。
),其反应类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4.2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
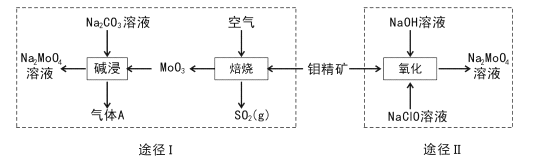
(l) Na2 MoO4![]() 2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
(2)途径I为了提高钼精矿焙烧速率,可采取的措施是____(答出两条即可)。
(3)途径I焙烧过程中化学方程式为____,碱浸时气体A的化学式为____。
(4)已知途径I的钼酸钠溶液中c(MoO42-)=0. 40mol/L,c(CO32-)=0. 20mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是____(已知Ksp(BaCO3) =1×10-9、Ksp(BaMo04) =4.0×10-8,忽略溶液的体积变化)。
(5)途径II氧化时溶液中还有Na2SO4生成,则还原剂与氧化剂物质的量之比为_____。
(6)途径I或途径II所得的Na2MoO4溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列各溶液中,下列有关说法正确的是
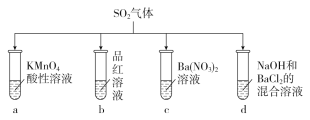
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,说明SO2具有还原性
D. 试管d中能产生白色沉淀,加入稀硝酸后沉淀完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中不正确的是
A. 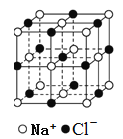 在NaCl晶体中,距Na+最近的Cl-形成正八面体
在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 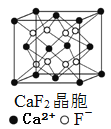 在CaF2晶体中,每个晶胞平均占有4个Ca2+
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.  在石墨晶体中,每个环上平均占有3个碳原子
在石墨晶体中,每个环上平均占有3个碳原子
D. 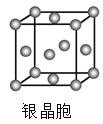 在银晶体中,银原子的配位数为12
在银晶体中,银原子的配位数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用磷肥副产物氟硅酸钠(Na2SiF6)为原料合成冰晶石(Na3AlF6)成为一条合理利用资源、提高经济效益的新方法。工艺流程如下图所示:
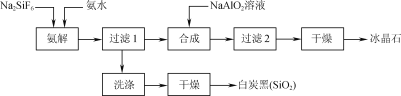
(1)传统合成冰晶石的方法是萤石(CaF2)法:使用萤石、石英和纯碱在高温下煅烧生成NaF,在NaF溶液中加入Al2(SO4)3溶液制得。在加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,
否则可能产生副产物____(填物质的化学式),但酸度不宜过强的原因是____。
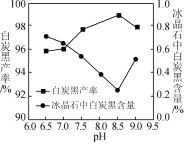
(2)氨解时白炭黑产率和冰晶石纯度与pH的关系如图,氨解时需要控制溶液的pH=____;能提高氨解速率的措施有____(填字母)。
A.快速搅拌
B.加热混合液至100℃
C.减小氨水浓度
(3)工艺流程中氨解反应的化学方程式为____;冰晶石合成反应的离子方程式为______。
(4)为了提高原料利用率,减少环境污染,可采取的措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z可用于防治骨质疏松,可通过X、Y经两步转化得到Z。下列说法正确的是( )
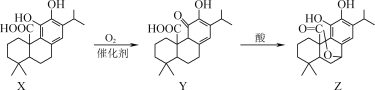
A. X、Y、Z都属于芳香族化合物
B. Y分子中含有3个手性碳原子
C. X、Y、Z与浓溴水反应最多消耗1molBr2
D. 1molZ与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小祖的同学设计利用C2H2气体制取H2C2O42H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用如图装置制取C2H2。

①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是____________________________ (写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为________________________。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如图所示:

①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为___________________________________。
③从装置D中得到产品,还需经过__________________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol/L酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定时高锰酸钾标准溶液盛放在滴定管中_____________(填“酸式”或“碱式”)。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是______________ 。
③产品中H2C2O4·2H2O的质量分数为_________________(列出含 m、c、V 的表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com