
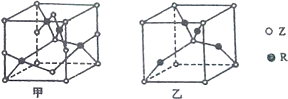
 已知元素W、X、Y、Z、R为前四周期元素,且原子序数依次增大.元素W的负一价阴离子与某惰性气体结构相同,X是形成化合物种类最多的元素,Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:
已知元素W、X、Y、Z、R为前四周期元素,且原子序数依次增大.元素W的负一价阴离子与某惰性气体结构相同,X是形成化合物种类最多的元素,Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:| 4+1-2-3 |
| 2 |
| 5+1-2×3 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 8 |
| m |
| V |
| ||
| (a×10-10cm)3 |
| 3.2×1033 |
| a3NA |
| 3.2×1033 |
| a3NA |


科目:高中化学 来源: 题型:
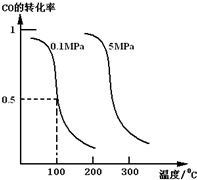 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)?CH3OH(g).
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)?CH3OH(g).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氟酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O |
| B、明矾用于净水:Al3++3H2O=Al(OH)3+3H+ |
| C、纯碱去除油污:CO32-+H2O?HCO3-+OH- |
| D、氯气制备“84”消毒液:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(A-)+c(OH-) |
| C、c(Na+)+c(OH-)=c(A-)+c(H+) |
| D、c(Na+)>c(OH-)>c(A-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸的质量增加 |
| B、铝的表面生成致密的氧化物薄膜 |
| C、澄清的石灰水变浑浊 |
| D、氢氧化钠固体发生潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、元素Y的简单气态氢化物的热稳定性比Z的强 |
| C、由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| D、化合物X2Z2与W2Z2所含化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
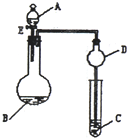 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
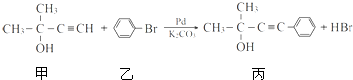
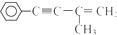 的反应条件是
的反应条件是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com