
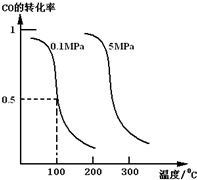
 �о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ����˫Ӯ�Ŀ��⣮�ڴ��������£�CO�����ںϳɼ״���CO��g��+2H2��g��?CH3OH��g����
�о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ����˫Ӯ�Ŀ��⣮�ڴ��������£�CO�����ںϳɼ״���CO��g��+2H2��g��?CH3OH��g����


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
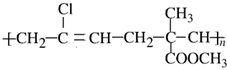 ���䵥�������Ϊ��������
���䵥�������Ϊ��������| A������ϩ����ϩ�ͼ���ϩ����� |
| B��2-��-1��3-����ϩ�Ͷ�ϩ����� |
| C��3-��-1��3-����ϩ�ͱ�ϩ����� |
| D��2-����ϩ�������2-��-1��3-����ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʽ�ζ���δ��ϴ��װ��Һ�ζ� |
| B����ȡ��Һ����ʱ���ζ�ǰƽ�ӣ��ζ����յ���� |
| C���ζ�ǰ��ʽ�ζ��ܼ��촦������δ�ų����ζ���������ʧ |
| D���ζ����յ�ʱ���ֵζ��ܼ��촦����һ��Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=1����Һ�У�Fe2+��NO3-��SO42-��Na+ | ||
| B����ˮ�����C��H+��=1��10-14mol?L-1����Һ�У�Ca2+��K+��Cl-��HCO3- | ||
C��
| ||
| D��c��Fe3+��=0.1mol?L-1����Һ�У�K+��SO42-��CO32-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaClO��Һ�У�c��Na+��=c��HClO��+c��ClO-�� |
| B��������������ʵ���Ũ�ȵ�NaX������HX��ϣ�������Һ�У�c��Na+����c��X-����c��H+����c��OH-�� |
| C����25mL0.2mol/L��������100mL0.1mol/L�İ�ˮ��ϣ�������Һ�У�c��NH4+����c��Cl-����c��NH3?H2O����c��OH-����c��H+�� |
| D����0.1mol/L��Na2S��Һ��0.1mol/L��NaHS��Һ�������ϣ�������Һ�У�c��Na+��+c��H+��=2c��S2-��+c��HS-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������Сһ�룬��ѹǿΪԭ�������� |
| B��ƽ�������ƶ������������ɫһ�����dz |
| C���������Сһ�룬ѹǿ����С��ԭ�������� |
| D��ƽ�������ƶ�����������ܶȼ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ԭ�Ӱ뾶��С˳��r��W����r��Z����r��Y����r��X�� |
| B��Z�����ڱ��е�λ��Ϊ��3���ڡ�IB�� |
| C��X������������Ӧˮ��������Ա�W���� |
| D��W��Y��������������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ۢݢ� | B���ڢܢޢ� |
| C���٢ܢޢ� | D�����Ͼ�����ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
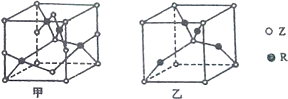 ��֪Ԫ��W��X��Y��Z��RΪǰ������Ԫ�أ���ԭ��������������Ԫ��W�ĸ�һ����������ij��������ṹ��ͬ��X���γɻ�������������Ԫ�أ�Zԭ��L���Ӳ�����2�ԳɶԵ��ӣ�R+ԭ�Ӻ�����3������Ҹ��������ȫ��״̬����ش��������⣺
��֪Ԫ��W��X��Y��Z��RΪǰ������Ԫ�أ���ԭ��������������Ԫ��W�ĸ�һ����������ij��������ṹ��ͬ��X���γɻ�������������Ԫ�أ�Zԭ��L���Ӳ�����2�ԳɶԵ��ӣ�R+ԭ�Ӻ�����3������Ҹ��������ȫ��״̬����ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com