

| 84g×cmol/L×Vml×10-3L/mol |
| 1mol |
84cV×10-3g×
| ||
| m1 |
| 0.42cV |
| m1 |
| 0.42cV |
| m1 |


科目:高中化学 来源: 题型:
| A、熵增大效应大于能量效应 |
| B、是放热反应 |
| C、是熵减少的反应 |
| D、是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、一个金刚石的晶胞中有8个C原子 |
| B、金刚石的密度为3.54g?cm-1 |
| C、在该种CO2晶体中,一个CO2分子由一个C原子和二个氧原子构成 |
| D、在该种CO2晶胞中含氧原子8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
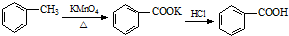
| 名称 | 性状 | 熔点 (℃) | 沸点 (℃) | 密度 (g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
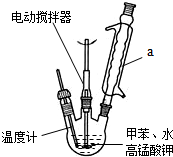 装置a的作用是
装置a的作用是 +
+ +
+查看答案和解析>>
科目:高中化学 来源: 题型:
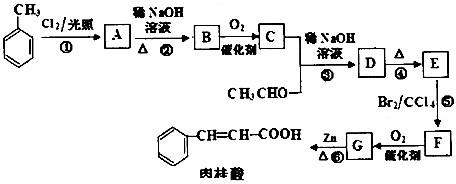
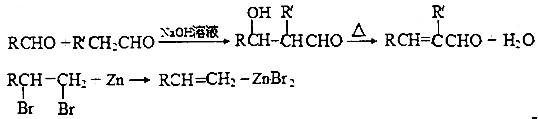
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com