
【题目】金属及其化合物在生产中用途广泛。
Ⅰ.从含铜丰富的自然资源黄铜矿(CuFeS2)冶练铜的工艺流程如下:
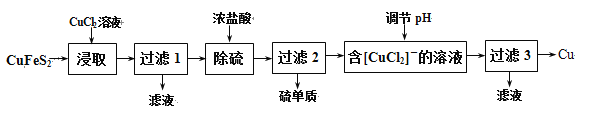
已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为 。
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是 。(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有 ,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为 。
Ⅱ.利用生产硼砂的废渣——硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:
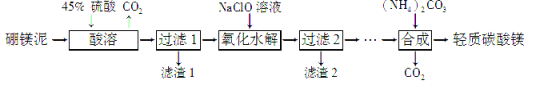
(1) 写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式 。
(2) 滤渣2的主要成分有MnO2和_____________,写出生成MnO2的离子方程式____________________。
(3)“合成”时需通蒸汽至80 ℃,边加热边搅拌,温度控制在80 ℃的原因是________________________(只需写出相应的化学方程式)。
【答案】Ⅰ.(1)CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓(2分)
(2)Fe2O3(1分)(3)Cu2+(1分)
(4)HCl和CuCl2(2分),0.5mol(2分)
Ⅱ.(1)MgCO3+2H+=Mg2++H2O+CO2↑(1分)
(2)Fe(OH)3(1分)Mn2++ClO-+H2O=MnO2↓+2H++Cl-(2分)
(3)(NH4)2CO3![]() 2NH3↑+H2O+CO2↑(2分)
2NH3↑+H2O+CO2↑(2分)
【解析】
试题分析:Ⅰ.(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为 CuFeS2 + 3FeCl3=CuCl↓+ 4FeCl2 + 2S↓。
(2)滤液中只含FeCl2,存在Fe2++2H2O![]() Fe(OH)2+2H+,加热促进水解,Fe(OH)2在空气中易氧化生成Fe(OH)3,生成的Fe(OH)3受热分解,最终所得固体的化学式为Fe2O3。
Fe(OH)2+2H+,加热促进水解,Fe(OH)2在空气中易氧化生成Fe(OH)3,生成的Fe(OH)3受热分解,最终所得固体的化学式为Fe2O3。
(3)+1价的Cu在酸性条件下发生歧化反应,生成0价和+2价铜,故调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是Cu2+;
(4)过滤3所得滤液中含有HCl和CuCl2,可以循环使用,每生成1molCu,理论上需补充CuCl2的物质的量为0.5mol。
Ⅱ.由制备流程可知,硼镁泥的主要成分为MgCO3、SiO2,还有少量Fe2O3、MnO、CaO等,向废渣中加硫酸时SiO2不溶解,过滤得到滤渣1为二氧化硅,NaClO具有氧化性,能将Mn2+氧化为MnO2,调节pH生成MnO2、Fe(OH)3沉淀,过滤得滤渣2为MnO2、Fe(OH)3,再经过系列除杂后所得溶液中加碳酸铵溶液,得到轻质碳酸镁,则
(1)MgCO3和硫酸反应生成硫酸镁和二氧化碳,反应方程式为MgCO3+2H+=Mg2++H2O+CO2↑;
(2)根据上面的分析可知滤渣2的主要成分为MnO2、Fe(OH)3,次氯酸钠能氧化锰离子生成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
(3)“合成”时在溶液中加碳酸铵溶液,得到轻质碳酸镁、硫酸铵和水,温度过低反应速率慢,温度过高轻质碳酸镁、碳酸铵会分解,反应的方程式为(NH4)2CO3 ![]() 2 NH3↑+H2O + CO2↑。
2 NH3↑+H2O + CO2↑。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是( )
A. 苏打——NaHCO3 B. 胆矾——ZnSO4
C. 酒精——C2H5OH D. 生石灰——Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池工作时氢气在负极被氧化
C.太阳能电池的主要材料是高纯度的二氧化硅
D.氢氧燃料电池可将热能直接转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g) △H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法不正确的是
qZ(g) △H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法不正确的是
A.通入稀有气体使压强增大,平衡不移动
B.增大压强同时又升高温度,反应速率加快且可以提高Z的产率
C.降低温度,混合气体的平均相对分子质量变大
D.增加X的物质的量,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)S2-、Fe2+、Fe3+、Mg2+、S、I-、H+,其中只有氧化性的是 ,只有
还原性的是 ,既有氧化性又有还原性的是 。
(2)氧化还原反应3S+6KOH=K2S+K2SO3+3H2O中,氧化产物是 ,该反应的
离子方程式为: 。
(3)已知 F是氧化性最强的元素,在与其他元素化合时只表现出负价,在3BrF3+5H2O=Br2+HBrO3+O2↑+9HF反应中,若有27克H2O参加反应,则被水还原的BrF3的分子数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com