
【题目】下列有关认识正确的是
A.各能级按![]() 、
、![]() 、
、![]() 、
、![]() 的顺序所容纳的最多电子数依次为1、3、5、7的2倍
的顺序所容纳的最多电子数依次为1、3、5、7的2倍
B.各能层的能级都是从![]() 能级开始至
能级开始至![]() 能级结束
能级结束
C.各能层含有的能级数为![]()
D.各能层含有的电子数为![]()
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)
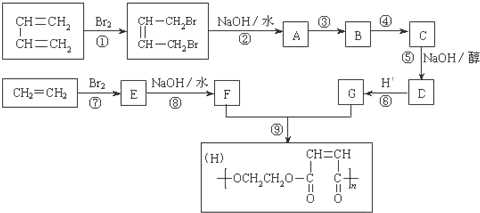
请按要求填空:
(1)写出下列反应的反应类型:反应① ___________ ; 反应⑤ ___________ 。
(2)反应②的化学方程式是:__________ 。
(3)反应③、④中有一反应是与HCl加成,该反应是______(填反应编号),设计这一步反应的目的是_____,物质C的结构简式是_____。
(4)写出与G具有相同种类和数目的官能团的同分异构体:________。
(5)写出由甲苯合成苯甲醛的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:
MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O
ZnSO4[Zn(OH)2]3·xH2O
其电池结构如图1所示,图2是有机高聚物的结构片段。

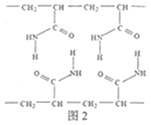
下列说法中,正确的是( )
A.碳纳米管具有导电性,可用作电极材料
B.放电时,电池的正极反应为MnO2-e-+H+=MnOOH
C.充电时,Zn2+移向MnO2
D.合成有机高聚物的单体是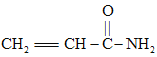
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卡巴拉丁F是老年人认知障碍的重要治疗药物。其合成路线如图所示:
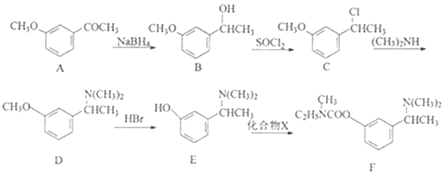
(1)B中含氧官能团的名称为___。
(2)B→C的反应类型为___。
(3)化合物X(C4H3ONCl)的结构简式为__。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式:__。
①能水解,水解产物之一能与FeCl3溶液发生显色反应。
②分子中含有4种不同化学环境的氢。
(5)已知:RX![]() RCN
RCN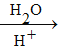 RCOOH
RCOOH
RX+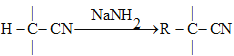
以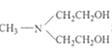 和苯为主要原料制备
和苯为主要原料制备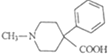 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常情况下,五种元素的单质中有三种气体,两种固体。
(1)A为______(填元素符号,下同),B为______,C为______;D的原子结构示意图为______。
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱:______![]() ______(填化学式)。
______(填化学式)。
(3)A和B可形成原子个数比为![]() 的化合物,其化学式为______。
的化合物,其化学式为______。
(4)将E的单质通入A、B、C三种元素组成的化合物的水溶液中,试写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种短周期元素![]() 、
、![]() ,
,![]() 元素原子的最外层电子数为
元素原子的最外层电子数为![]() ,次外层电子数为
,次外层电子数为![]() ;
;![]() 元素原子的
元素原子的![]() 层(有电子)电子数为
层(有电子)电子数为![]() ,
,![]() 层电子数为
层电子数为![]() 。
。
(1)推断元素名称和符号:![]() _______、______,
_______、______,![]() ______、_______。
______、_______。
(2)![]() 、
、![]() 两元素形成的化合物可能具有的性质是_______(填序号)。
两元素形成的化合物可能具有的性质是_______(填序号)。
A.能与水反应 B.能与硫酸反应 C.能与氢氧化钠溶液反应
(3)![]() 元素的原子含有_______个能层,Y元素的原子含有_______个能层。
元素的原子含有_______个能层,Y元素的原子含有_______个能层。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点﹣36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
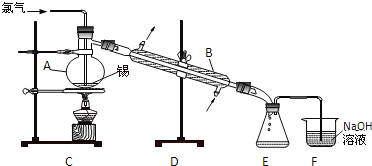
完成下列填空:
(1)仪器A的名称__; 仪器B的名称__.
(2)实验室制得的氯气中含HCl和水蒸气,须净化后再通入液态锡中反应,除去HCl的原因可能是__;除去水的原因是__.
(3)当锡熔化后,通入氯气开始反应,即可停止加热,其原因是__.若反应中用去锡粉11.9g,反应后在锥形瓶中收集到23.8g SnCl4,则SnCl4的产率为__.
(4)SnCl4遇水强烈水解的产物之一是白色的固态二氧化锡.若将SnCl4少许暴露于潮湿空气中,预期可看到的现象是__.
(5)已知还原性Sn2+>I﹣,SnCl2也易水解生成难溶的Sn(OH)Cl.如何检验制得的SnCl4样品中是否混有少量的SnCl2?__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易粉碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产Ni2O3的工艺流程如下:
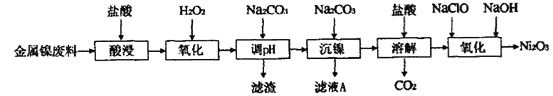
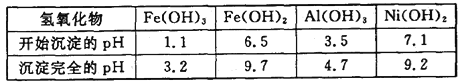
下表为金属离子生成氢氧化物沉淀的pH(设开始沉淀时金属离子浓度为1.0 mol·L-1):
回答下列问题:
(1)为提高金属镍废料浸出的速率,在“酸浸”时可采取的措施是___________。(写两点即可)
(2)酸浸后的酸性溶液中含有Ni2+、Fe2+、Fe3+、Al3+等。加H2O2的作用是__________,其离子方程式为______________________。
(3)在沉镍前,需加Na2CO3控制溶液pH的范围为__________。
(4)沉镍的离子方程式为_____________________。
(5)氧化生成Ni2O3的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
A. 4种溶液pH的大小顺序:①>④>③>②
B. 溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O)
C. 向溶液①、②中分别加入25 mL 0.1mol/L盐酸后,溶液中c(NH4+):①>②
D. 向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com