
����Ŀ��X��Y��Z��W���ֶ�����Ԫ�ص�ԭ��������������ԭ������������֮��Ϊ13��X��ԭ�Ӱ뾶��Y��С��X��Wͬ���壬Z��������������������3��������˵������ȷ����
A.����Ԫ�ؼ����ӵİ뾶��X<Y<Z<W
B.X��Y�γɵ����ӻ������мȺ����Ӽ��ֺ����ۼ�
C.���ӻ�����W2Z2������������֮��Ϊ1:1
D.ֻ��X��Y��Z����Ԫ�صĻ�����һ���ǹ��ۻ�����
���𰸡�B
��������
����֪��Z����Ԫ�أ���X�ǵڶ�����Ԫ�أ�����ͬʱ���㡰ԭ�������������͡�X��ԭ�Ӱ뾶��Y��С������X����Ԫ�أ���W����Ԫ�أ��������������֮��Ϊ13֪��Y�ǵ�Ԫ�ء�
A.�����ӵİ뾶![]() ����X<W <Z<Y��A�����
����X<W <Z<Y��A�����
B.NH4H�мȺ����Ӽ��ֺ����ۼ���B����ȷ��
C.��������������������֮��Ϊ1:2��C�����
D.ֻ��H��N��O����Ԫ�صĻ���������ǹ��ۻ���������Ҳ���������ӻ����������泥�D�����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ�������̼�IJ����������ҹ���Դ�����һ����Ҫս�Է���
��1���û���̿��ԭ�����Դ�������β���еĵ������ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO��������ӦC(s)+ 2NO(g)![]() N2(g)+CO2(g) ��H����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��/(mol/L)/ʱ��/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 080 | 0.80 | 1.2 |
�ٸ���ͼ�����ݷ���T1��ʱ���÷�Ӧ��0��10min�ڵ�ƽ����Ӧ����v(N2)��___mol��L-1��min-1������÷�Ӧ��ƽ�ⳣ��K��__��
����30min��ֻ�ı�ijһ���������ϱ��е������жϸı������������__������ĸ��ţ���
A.������ʵĴ��� B.�ʵ���С���������
C.ͨ��һ������NO D.����һ�����Ļ���̿
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ2��3��3����ﵽ��ƽ��ʱNO��ת����___����������������������������H__0������>������<������
��2����ҵ����CO2��H2��Ӧ�ϳɶ����ѡ���֪��
CO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g) ��H1����49.1kJ��mol-1
CH3OH(g)��H2O(g) ��H1����49.1kJ��mol-1
2CH3OH(g) ![]() CH3OCH3(g)��H
CH3OCH3(g)��H
д��CO2(g)��H2(g)ת��ΪCH3OCH3(g)��H2O(g)���Ȼ�ѧ����ʽ___��
��3�������£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
����ij�β���õ�pH=10����Һ������Һ��c(CO32��)��c(HCO3��)=__��[������K1(H2CO3)=4.4��10-7��K2(H2CO3)=5��10-11]��
�� ����5L Na2CO3��Һ��23.3 g BaSO4����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ_________��[��֪��������Ksp(BaSO4)=1��10-7��Ksp(BaCO3)=2.5��10-6]����������Һ������ı仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�д�������ƽ�⣬�绯ѧƽ�⡢����ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ��ȵȣ���Ӧ���л�ѧƽ�ⳣ��������ƽ�ⳣ���ȡ���Ҫ��ش��������⣺
��1����ӦH2(g)+I2(g)2HI(g)��ƽ�ⳣ��ΪK1����ӦHI(g)![]() H2(g)+
H2(g)+![]() I2(g)��ƽ�ⳣ��ΪK2����K1��K2֮��Ĺ�ϵʽΪ___(ƽ�ⳣ��Ϊͬ�¶��µIJⶨֵ)
I2(g)��ƽ�ⳣ��ΪK2����K1��K2֮��Ĺ�ϵʽΪ___(ƽ�ⳣ��Ϊͬ�¶��µIJⶨֵ)
��2����������ԭ��Ϊ2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H<0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ��˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����___��
2CO2(g)+N2(g) ��H<0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ��˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����___��

��3��ij��Ԫ��(����ʽ��H2B��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2B=H++HB-��HB-H++B2-����0.1mol/L��Na2B��Һ�У���������Ũ�ȹ�ϵʽ��ȷ����___��
A.c(B2-)+c(HB-)=0.1mol/L B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
��4���±�Ϊ������ĵ���ƽ�ⳣ��
CH3COOH | H2CO3 | H2S |
1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=9.1��10-8 K2=1.1��10-12 |
��pH��ͬ��CH3COONa��Na2CO3��NaHS��Һ���ʵ���Ũ���ɴ�С��˳��Ϊ___������CO2��NaHS��Ӧ�����ӷ���ʽΪ___��
��5��25��ʱ����0.01molL-1��MgCl2��Һ�У���μ���ŨNaOH��Һ���պó��ֳ���ʱ����Һ��pHΪ___����Mg2+��ȫ����ʱ����Һ��pHΪ___(������Һ����仯����֪25��ʱ��Ksp[Mg(OH)2]=1.8��10-11����֪lg2.4=0.4��lg7.7=0.9��
��6����֪25��ʱ��Ksp[Fe(OH)3]=2.79��10-39�����¶��·�Ӧ��Fe(OH)3+3H+Fe3++3H2O��ƽ�ⳣ��K=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������Ӧ�������Լ����۶���ȷ�����߾��������ϵ����
ѡ�� | ʵ�� | ���� | ���� |
A | ��1mL 0.1mol/L AgNO3��Һ�е���2��0.1 mol/L ��NaCl��Һ�����������Һ�е���2��0.1 mol/L KI��Һ������� | �Ȳ�����ɫ����������ֻ�ɫ���� | Ksp(AgCl) >Ksp (AgI) |
B | һ�������£��ܱ�������Ӧ��ƽ�⣺ H2(g)+I2(g) | ������ɫ���� | ƽ������ |
C | ���������pH��HA��HB��������Һ�ֱ��������Ĵ�С��ͬ��п��Ӧ | ��Ӧ��ʼ��HA����H2�����ʸ��� | HA������ |
D | ��п����ϡ���ᷴӦ���Թ��еμӼ���CuSO4��Һ | ����������������Լӿ� | CuSO4�Ը÷�Ӧ�д����� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ����������ȷ����( )
A.������ȼ����Ϊ285.5 kJmol-1,��ˮ�����Ȼ�ѧ����ʽΪ:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g) ![]() H=+285.8kJmol-1
H=+285.8kJmol-1
B.1mol������ȫȼ������CO2 (g)��H2O(l)ʱ�ų�890kJ����,�����Ȼ�ѧ����ʽΪ 1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1
H=-445kJmol-1
C.��֪2C(s)+O2(g) ![]() 2CO(g)
2CO(g) ![]() H=-221kJmol-1,��C��ȼ����Ϊ110.5 kJmol-1
H=-221kJmol-1,��C��ȼ����Ϊ110.5 kJmol-1
D.HF��NaOH��Һ��Ӧ:H+(aq)+OH-(aq) = H2O(l) ![]() H=-57.3kJmol-1
H=-57.3kJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������ͨ��5 min����ͭ�缫���������ӣ��Իش�
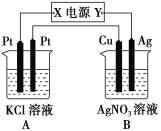
(1)��Դ�缫X������Ϊ______(��������������������)��
(2)����B�������ĵ缫��Ӧʽ�ǣ�__________________________________________��
(3)��KCl��Һ�������200 mL����ͭ�缫����������2.16 gʱA����Һ��pH��________(���Ե��ǰ����Һ����ı仯)����Ҫʹ�������Һ�ָ�
������ǰ��ȫ��ͬ��״̬����Ӧ����________(�����ʵ����༰���ʵ���)��
(4)��ͭ�������缫��������Ϊ2.16 gʱ��A�����ɵ��������Ϊ________ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������ʵ�����N2��g����O2��g���ں����ܱ������з�Ӧ��N2��g��+O2��g��2NO��g��������a��ʾ�÷�Ӧ���¶�T��ʱN2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯��������ȷ���ǣ�������

A.�¶�T���£��÷�Ӧ��ƽ�ⳣ��K=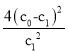
B.�¶�T���£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C.����b��Ӧ�������ı�����Ǽ����˴���
D.������b�ı���������¶ȣ���÷�Ӧ��H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(N2H4)��ˮ��Һ���У�
�� N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
�� N2H5++H2O![]() N2H62++OH- K2 ��
N2H62++OH- K2 ��
����Һ�е��������ʵ���������(X)��-lgc(OH-)�仯�Ĺ�ϵ��ͼ��ʾ�����������������

A. ͼ�Т��Ӧ����ΪN2H62+
B. ��Ӧ��ΪN2H5+��ˮ��ƽ�ⷽ��ʽ
C. ��C��ΪN2H5C1��Һ������ڣ�c(Cl-)>c(N2H5+ )+2c(N2H62+)
D. ��A�����K1=10-6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�������Ҫ�ɷ�ΪPbS�������������ַ�����Ǧ������ұ������Ǧ��
I.����Ǧ��Ǧ�����ڿ����б��գ�����PbO��SO2��
(1) ��Ǧ�������Ǧ�ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_________��
(2) ����Ǧ�ķ����к���Ũ��SO2���ɽ�����ͨ�������ˮ�н��д�������Ӧ�����ӷ���ʽΪ��__________��
II.ʪ����Ǧ���Ʊ�����Ǧ��ͬʱ�������Ƶ���ǣ�����ڻ���Ǧ��Ϊ������ʪ����Ǧ�Ĺ����������£�

��֪��PbCl2��ˮ���ܽ��С����Cl��Ũ�Ƚϴ����Һ�У�����ƽ�⣺PbCl2(s) + 2Cl��(aq)PbCl42��(aq) H��0
(3) ��ȡǦ����ʱ������Ӧ�����ӷ���ʽ��________��
(4) ����Һ1������ PbCl2�IJ���a��_______��
(5) ����Һ3����Һ2�ֱ�������ͼ��ʾ���װ�õ����������У�����ȡ����Ǧ��ʹ��ȡҺ�е�FeCl3������

����Һ3Ӧ����______(������������������������)�С�
�ڼ�����Һ2��������ΪFeCl3�Ŀ���ԭ����_________
����Ǧ���������Ϊa g��Ǧ������Ϊb ����������ͨ��c mol����ʱ������Ǧȫ��������Ǧ������PbS�����������ļ���ʽΪ____________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com