
°æƒø°ø«¶æ´øÛµƒ÷˜“™≥…∑÷Œ™PbS£¨œ÷”√œ¬¡–¡Ω÷÷∑Ω∑®¥”«¶æ´øÛ÷–“±¡∂Ω Ù«¶°£
I.ª∑®¡∂«¶Ω´«¶æ´øÛ‘⁄ø’∆¯÷–±∫…’£¨…˙≥…PbO∫ÕSO2°£
(1) ”√«¶æ´øÛª∑®¡∂«¶µƒ∑¥”¶÷–—ıªØº¡”Ϊπ‘≠º¡µƒŒÔ÷ µƒ¡ø÷Ʊ»Œ™_________°£
(2) ª∑®¡∂«¶µƒ∑œ∆¯÷–∫¨µÕ≈®∂»SO2£¨ø…Ω´∑œ∆¯Õ®»Îπ˝¡ø∞±ÀÆ÷–Ω¯––¥¶¿Ì£¨∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™£∫__________°£
II. ™∑®¡∂«¶‘⁄÷∆±∏Ω Ù«¶µƒÕ¨ ±£¨ªπø…÷∆µ√¡Úª«£¨œý∂‘”⁄ª∑®¡∂«¶∏¸Œ™ª∑±£°£ ™∑®¡∂«¶µƒπ§“’¡˜≥ûÁœ¬£∫

“—÷™£∫PbCl2‘⁄ÀÆ÷–»ÐΩ‚∂»–°£¨‘⁄Cl£≠≈®∂»Ωœ¥Ûµƒ»Ð“∫÷–£¨¥Ê‘⁄∆Ω∫‚£∫PbCl2(s) + 2Cl£≠(aq)PbCl42£≠(aq) H£æ0
(3) Ω˛»°«¶æ´øÛ ±∑¢…˙∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ω «________°£
(4) ”…¬À“∫1÷–Œˆ≥ˆ PbCl2µƒ≤Ÿ◊˜a «_______°£
(5) Ω´»Ð“∫3∫Õ¬À“∫2∑÷±÷√”⁄»ÁÕºÀ˘ æµÁΩ‚◊∞÷√µƒ¡Ω∏ˆº´ “÷–£¨ø…÷∆»°Ω Ù«¶≤¢ πΩ˛»°“∫÷–µƒFeCl3‘Ÿ…˙°£

¢Ÿ»Ð“∫3”¶÷√”⁄______(ÃÓ°∞“ıº´ “°±ªÚ°∞—Ùº´ “°±)÷–°£
¢⁄ºÚ ˆ¬À“∫2µÁΩ‚∫Û‘Ÿ…˙Œ™FeCl3µƒø…ƒÐ‘≠¿Ì£∫_________
¢€»Ù«¶æ´øÛµƒ÷ ¡øŒ™a g£¨«¶Ω˛≥ˆ¬ Œ™b £¨µ±µÁΩ‚≥ÿ÷–Õ®π˝c molµÁ◊” ±£¨Ω Ù«¶»´≤øŒˆ≥ˆ£¨«¶æ´øÛ÷–PbSµƒ÷ ¡ø∑÷ ˝µƒº∆À„ ΩŒ™____________
°æ¥∞∏°ø3:2 SO2+2NH3.H2O= SO32£≠+2NH4++ H2O PbS+2Fe3++4Cl£≠= PbCl42£≠+ 2Fe2++S°˝ ΩµµÕŒ¬∂»£¨º”ÀÆœ° Õ “ıº´ “ —Ùº´ “÷–Fe2+£≠2e£≠= Fe3+£¨“ıº´ “µƒCl£≠∂®œÚ“∆∂ØµΩ—Ùº´ “£¨ µœ÷FeCl3µƒ‘Ÿ…˙ ![]()
°æΩ‚Œˆ°ø
(1)¡ÚªØ«¶‘⁄ø’∆¯÷–±∫…’…˙≥…PbO∫ÕSO2£¨ È–¥—ıªØªπ‘≠∑¥”¶∑Ω≥Ã Ω£¨»ª∫ÛΩ¯––∑÷Œˆ£ª
(2)SO2Œ™À·–‘∆¯Ã£¨∞±ÀÆœ‘ºÓ–‘£¨∑¥”¶…˙≥…(NH4)2SO3£ª
(3)∏˘æð¡˜≥ã¨PbS÷–S◊™ªØ≥…Sµ•÷ £¨¿˚”√¡ÀFe3£´µƒ—ıªØ–‘£¨∏˘æð–≈œ¢£¨ È–¥≥ˆ¿Î◊”∑Ω≥Ã Ω£ª
(4)PbCl2‘⁄ÀÆ÷–»ÐΩ‚∂»–°£¨‘⁄Cl£≠≈®∂»Ωœ¥Ûµƒ»Ð“∫÷–£¨¥Ê‘⁄£∫PbCl2(s) + 2Cl£≠(aq)PbCl42£≠(aq) H£æ0£¨ªÒµ√PbCl2£¨»√∆Ω∫‚œÚƒÊ∑¥”¶∑ΩœÚΩ¯––£ª
(5)¢Ÿ∏˘æð¡˜≥êҵ√Pb£¨Pb‘™ÀÿµƒªØ∫œº€ΩµµÕ£¨∏˘æðµÁΩ‚‘≠¿Ì£¨”¶Ω´»Ð“∫3÷√”⁄“ıº´ “£ª
¢⁄∏˘æð¡˜≥㨬À“∫2÷–∫¨”–Fe2£´£¨ªÒµ√FeCl3£¨ªØ∫œº€…˝∏þ£¨–Ë“™Ω´¬À“∫2∑≈»Î—Ùº´ “£ª
¢€∏˘æðPb‘™Àÿ ÿ∫„Ω¯––∑÷Œˆ∫Õº∆À„£ª
(1)∑¥”¶∑Ω≥Ã ΩŒ™2PbS + 3O2= 2PbO+2SO2£¨S‘™ÀÿµƒªØ∫œº€…˝∏þ£¨Pb‘™ÀÿµƒªØ∫œº€≤ª±‰£¨º¥PbSŒ™ªπ‘≠º¡£¨—ı∆¯Œ™—ıªØº¡£¨—ıªØº¡”Ϊπ‘≠º¡µƒŒÔ÷ µƒ¡ø÷Ʊ»Œ™3:2£ª
¥∞∏£∫3£∫2£ª
(2)”…”⁄∞±ÀÆπ˝¡ø£¨∑¥”¶…˙≥…’˝—Œ£¨¿Î◊”∑Ω≥Ã ΩŒ™£∫SO2+2NH3.H2O= SO32£≠+2NH4++ H2O£ª
¥∞∏£∫SO2+2NH3.H2O= SO32£≠+2NH4++ H2O£ª
(3)∏˘æð¡˜≥㨬À‘¸1÷–∫¨”–¡Úµ•÷ £¨Àµ√˜PbS÷–µƒS‘™Àÿ◊™ªØ≥…Sµ•÷ £¨ªØ∫œº€…˝∏þ£¨Fe3£´◊˜—ıªØº¡£¨∏˘æð–≈œ¢£¨Pb‘™Àÿ“‘PbCl42£≠£¨“Ú¥ÀΩ˛»°∑¢…˙¿Î◊”∑Ω≥Ã ΩŒ™PbS+2Fe3++4Cl£≠= PbCl42£≠+ 2Fe2++S°˝£ª
¥∞∏£∫PbS+2Fe3++4Cl£≠= PbCl42£≠+ 2Fe2++S°˝£ª
(4)¬À“∫1÷–«¶‘™Àÿ¥Ê‘⁄µƒ–Œ ΩŒ™PbCl42£≠£¨”…”⁄PbCl2(s) + 2Cl£≠(aq) ![]() PbCl42£≠(aq) H£æ0£¨ΩµµÕŒ¬∂»∫Õº”ÀÆœ° Õ”–¿˚”⁄∆Ω∫‚ƒÊœÚ“∆∂Ø£ª
PbCl42£≠(aq) H£æ0£¨ΩµµÕŒ¬∂»∫Õº”ÀÆœ° Õ”–¿˚”⁄∆Ω∫‚ƒÊœÚ“∆∂Ø£ª
¥∞∏Œ™ΩµµÕŒ¬∂»£¨º”ÀÆœ° Õ£ª
(5)¢Ÿ»Ð“∫3∫Õ¬À“∫2÷–µƒ»Ð÷ ∑÷±∫¨”–PbCl42£≠∫ÕFeCl2£¨µÁΩ‚÷–“™ µœ÷FeCl2◊™±‰Œ™FeCl3£¨∑¢…˙—ıªØ∑¥”¶£¨π ¬À“∫2¥¶”⁄—Ùº´ “£¨PbCl42£≠◊™±‰Œ™Pb£¨∑¢…˙ªπ‘≠∑¥”¶£¨»Ð“∫3¥¶”⁄“ıº´ “£ª
¥∞∏£∫“ıº´ “£ª
¢⁄∏˘æð¢Ÿ∑÷Œˆ£¨ªÒµ√FeCl3‘Ÿ…˙£¨—Ùº´ “÷–Fe2+£≠2e£≠= Fe3+£¨“ıº´ “µƒCl£≠∂®œÚ“∆∂ØµΩ—Ùº´ “£¨ µœ÷FeCl3µƒ‘Ÿ…˙£ª
¥∞∏£∫—Ùº´ “÷–Fe2+£≠2e£≠= Fe3+£¨“ıº´ “µƒCl£≠∂®œÚ“∆∂ØµΩ—Ùº´ “£¨ µœ÷FeCl3µƒ‘Ÿ…˙£ª
¢€…Ë«¶æ´øÛ÷–PbSµƒ÷ ¡ø∑÷ ˝Œ™x£¨PbCl42£≠ªÒµ√2mole£≠…˙≥…Pb£¨µÁΩ‚≥ÿ÷–Õ®cmolµÁ◊” ±£¨ªÒµ√n(Pb)=![]() mol£¨∏˘æ𫶑™Àÿ ÿ∫„£¨µ√≥ˆ
mol£¨∏˘æ𫶑™Àÿ ÿ∫„£¨µ√≥ˆ![]() =
=![]() mol£¨º∆À„≥ˆPbSµƒ÷ ¡ø∑÷ ˝Œ™
mol£¨º∆À„≥ˆPbSµƒ÷ ¡ø∑÷ ˝Œ™![]() £ª
£ª
¥∞∏£∫![]() °£
°£


 ‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øX°¢Y°¢Z°¢WÀƒ÷÷∂Ã÷Ð∆⁄‘™Àÿµƒ‘≠◊”–Ú ˝“¿¥Œ‘ˆ¥Û£¨‘≠◊”◊ÓÕ‚≤„µÁ◊” ˝÷Æ∫ÕŒ™13£¨Xµƒ‘≠◊”∞Îæ∂±»Yµƒ–°£¨X”ÎWÕ¨÷˜◊£¨Zµƒ◊Â–Ú ˝ «∆‰÷Ð∆⁄ ˝µƒ3±∂£¨œ¬¡–Àµ∑®÷–’˝»∑µƒ «
A.Àƒ÷÷‘™ÀÿºÚµ•¿Î◊”µƒ∞Îæ∂£∫X<Y<Z<W
B.X”ÎY–Œ≥…µƒ¿Î◊”ªØ∫œŒÔ÷–º»∫¨¿Î◊”º¸”÷∫¨π≤º€º¸
C.¿Î◊”ªØ∫œŒÔW2Z2÷–“ı—Ù¿Î◊” ˝÷Ʊ»Œ™1:1
D.÷ª∫¨X°¢Y°¢Z»˝÷÷‘™ÀÿµƒªØ∫œŒÔ“ª∂® «π≤º€ªØ∫œŒÔ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øÕ≠–ø‘≠µÁ≥ÿ£®»ÁÕº£©π§◊˜ ±£¨œ¬¡–– ˆ¥ÌŒÛµƒ «£® £©

A. ’˝º´∑¥”¶Œ™£∫Cu2++2e®C= Cu
B. µÁ≥ÿ∑¥”¶Œ™£∫Zn+Cu2+=Zn2+ +Cu
C. ‘⁄Õ‚µÁ¬∑÷–£¨µÁ◊”¥”∏∫º´¡˜œÚ’˝º´
D. —Œ«≈÷–µƒK+“∆œÚZnSO4»Ð“∫
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™∑¥”¶£∫H2(g)£´![]() O2(g)=H2O(g) ¶§H1
O2(g)=H2O(g) ¶§H1
![]() N2(g)£´O2(g)=NO2(g) ¶§H2
N2(g)£´O2(g)=NO2(g) ¶§H2
![]() N2(g)£´3/2H2(g)=NH3(g) ¶§H3
N2(g)£´3/2H2(g)=NH3(g) ¶§H3
‘Ú∑¥”¶2NH3(g)£´![]() O2(g)=2NO2(g)£´3H2O(g)µƒ¶§HŒ™£® £©
O2(g)=2NO2(g)£´3H2O(g)µƒ¶§HŒ™£® £©
A. 2¶§H1£´2¶§H2£≠2¶§H3B. ¶§H1£´¶§H2£≠¶§H3
C. 3¶§H1£´2¶§H2£´2¶§H3D. 3¶§H1£´2¶§H2£≠2¶§H3
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∑œƒ¯¥þªØº¡÷–÷˜“™”–Ni£¨ªπ”–Al°¢Fe°¢SiO2º∞∆‰À¸≤ª»Ð”⁄À·°¢ºÓµƒ‘”÷ °£œ÷”√∑œƒ¯¥þªØº¡÷∆±∏NiSO4°§7H2Oæßã¨∆‰¡˜≥ûÁÕº£∫
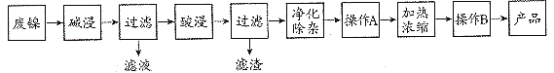
“—÷™£∫Ksp[Fe(OH)3]=8.0°¡10£≠38£¨Ksp[Fe(OH)2]=8.0°¡10£≠16£¨Ksp[Al(OH)3]=3.2°¡10£≠34£¨Ksp[Ni(OH)2]=2.0°¡10£≠15£¨1g2=0.3£¨
ªÿ¥œ¬¡–Œ Â
£®1£©°∞À·Ω˛ ±∑¢…˙µƒ¿Î◊”∑Ω≥Ã ΩŒ™Fe+2H+=Fe2++H2°¸°¢____°£
£®2£©°∞檪Ø≥˝‘”–Ë“™œ»º”»ÎH2O2»Ð“∫£¨∑¢…˙∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™___°£
£®3£©Ni2+‘⁄«øºÓ–‘»Ð“∫÷–ªπø…±ªNaClO—ıªØŒ™NiOOH£¨∏√∑¥”¶¿Î◊”∑Ω≥Ã ΩŒ™___°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“‘∏ıÃ˙øÛ(÷˜“™≥…∑÷Œ™FeO°§Cr2O3£¨ªπ∫¨”–Al2O3µ»‘”÷ )Œ™‘≠¡œ÷∆±∏Ω Ù∏ıµƒπ§“’¡˜≥ûÁÕºÀ˘ æ£∫

£®1£©°∞±∫…’°±∫ÛÀ˘µ√πÃÃÂŒ™Na2CrO4°¢Fe2O3∫ÕNaAlO2°£
¢Ÿ°∞±∫…’°± ±FeO°§Cr2O3∑¢…˙∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™____°£
¢⁄°∞±∫…’°± ±Al2O3∑¢…˙∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™____°£
£®2£©°∞µ˜pH=7°± ±…˙≥…Al(OH)3µƒ¿Î◊”∑Ω≥Ã ΩŒ™____°£
£®3£©°∞π˝¬À°±À˘µ√¬À‘¸Œ™Cr(OH)3£¨°∞ªπ‘≠°±∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™____°£
£®4£©°∞“±¡∂°± ±µƒªØ—ß∑Ω≥Ã ΩŒ™____°£
£®5£©∫¨¥◊À·µƒÀ·–‘∑œÀÆø…”√Õº2À˘ æ∑Ω∑®¥¶¿Ì£¨–¥≥ˆ∏∫º´µƒµÁº´∑¥”¶ Ω£∫____°£
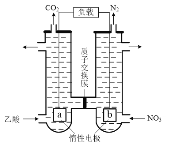
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø≈«‚ªØƒ∆(NaBH4)ø…”√◊˜ªπ‘≠º¡∫ÕÀСœ∑¢≈𺡰£À¸‘⁄¥þªØº¡◊˜”√œ¬”ÎÀÆ∑¥”¶ªÒ»°«‚∆¯µƒŒ¢π€π˝≥ûÁÕºÀ˘ æ°£œ¬¡–Àµ∑®≤ª’˝»∑µƒ «
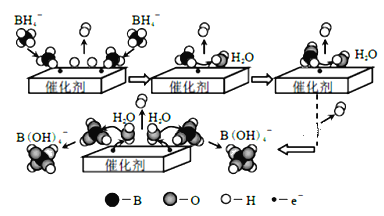
A.NaBH4÷–«‚‘™ÀÿµƒªØ∫œº€Œ™+1º€
B.»Ù”√D2O¥˙ÃÊH2O£¨∑¥”¶∫Û…˙≥…µƒ∆¯ÃÂ÷–∫¨”–H2°¢HD∫ÕD2
C.Õ®π˝øÿ÷∆¥þªØº¡µƒ”√¡ø∫Õ±Ì√ʪ˝£¨ø…“‘øÿ÷∆«‚∆¯µƒ≤˙…˙ÀŸ¬
D.NaBH4 ”ÎÀÆ∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™£∫BH4£≠+4H2O=B(OH)4£≠+4H2
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø‘⁄1200 °Ê ±£¨ÃÏ»ª∆¯Õ—¡Ú𧓒÷–ª·∑¢…˙œ¬¡–∑¥”¶£∫H2S(g)£´![]() O2(g)= SO2(g)£´H2O(g)°°¶§H1£¨H2S(g)£´
O2(g)= SO2(g)£´H2O(g)°°¶§H1£¨H2S(g)£´![]() O2(g)= S(g)£´H2O(g)°°¶§H2£¨2H2S(g)£´SO2(g)=
O2(g)= S(g)£´H2O(g)°°¶§H2£¨2H2S(g)£´SO2(g)= ![]() S2(g)£´2H2O(g)°°¶§H3£¨2S(g)= S2(g)°°¶§H4 £¨‘Ú¶§H4µƒ’˝»∑±Ì¥Ô ΩŒ™£® £©
S2(g)£´2H2O(g)°°¶§H3£¨2S(g)= S2(g)°°¶§H4 £¨‘Ú¶§H4µƒ’˝»∑±Ì¥Ô ΩŒ™£® £©
A.¶§H4£Ω![]() (¶§H1£´¶§H3£≠3¶§H2)B.¶§H4£Ω
(¶§H1£´¶§H3£≠3¶§H2)B.¶§H4£Ω![]() (3¶§H2£≠¶§H1£≠¶§H3)
(3¶§H2£≠¶§H1£≠¶§H3)
C.¶§H4£Ω![]() (¶§H1£´¶§H3£≠3¶§H2)D.¶§H4£Ω
(¶§H1£´¶§H3£≠3¶§H2)D.¶§H4£Ω![]() (¶§H1£≠¶§H3£≠3¶§H2)
(¶§H1£≠¶§H3£≠3¶§H2)
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø”…∫¨µ‚∑œÀÆ÷∆»°µ‚À·ºÿµƒ“ª÷÷𧓒»Áœ¬£∫

°∞÷∆KI(aq)°± ±£¨∏√Œ¬∂»œ¬ÀƵƒ¿Î◊”ª˝Œ™Kw£Ω1.0°¡10£≠13£¨Ksp[Fe(OH)2]£Ω9.0°¡10£≠15°£Œ™±Ð√‚0.9 mol°§L£≠1 FeI2»Ð“∫÷–Fe2+ÀÆΩ‚…˙≥…Ω∫◊¥ŒÔŒ¸∏ΩI-£¨∆ ºº”»ÎK2CO3±ÿ–α£≥÷»Ð“∫µƒpH≤ª¥Û”⁄______°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com