
【题目】硼氢化钠(NaBH4)可用作还原剂和塑料发泡剂。它在催化剂作用下与水反应获取氢气的微观过程如图所示。下列说法不正确的是
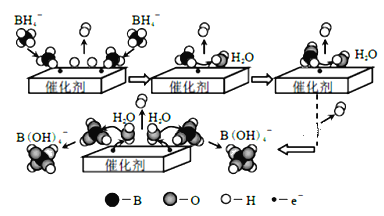
A.NaBH4中氢元素的化合价为+1价
B.若用D2O代替H2O,反应后生成的气体中含有H2、HD和D2
C.通过控制催化剂的用量和表面积,可以控制氢气的产生速率
D.NaBH4 与水反应的离子方程式为:BH4-+4H2O=B(OH)4-+4H2
科目:高中化学 来源: 题型:
【题目】一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )

A.温度T℃下,该反应的平衡常数K=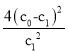
B.温度T℃下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b改变的条件是温度,则该反应△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2.下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) △H1=+571.6kJmol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJmol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
A. 反应CH4(g)= C(s)+2 H2(g)的△H=+74.8kJmol﹣1 。
B. 电解水也可制取氢气和氧气,而且比方法①更方便,更节能。
C. 反应②每生成2g氢气,要吸收131.3kJ的热量,所以该反应没有应用价值。
D. 反应③中,若将各1mol的甲烷与水蒸气混合,要吸收206.1kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿的主要成分为PbS,现用下列两种方法从铅精矿中冶炼金属铅。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1) 用铅精矿火法炼铅的反应中氧化剂与还原剂的物质的量之比为_________。
(2) 火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为:__________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:PbCl2在水中溶解度小,在Cl-浓度较大的溶液中,存在平衡:PbCl2(s) + 2Cl-(aq)PbCl42-(aq) H>0
(3) 浸取铅精矿时发生反应的离子方程式是________。
(4) 由滤液1中析出 PbCl2的操作a是_______。
(5) 将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于______(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的可能原理:_________
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年《化学教育》期刊封面刊载如图所示的有机物M(只含C、H、O)的球棍模型图。不同大小、颜色的小球代表不同的原子,小球之间的“棍”表示共价键,既可以表示三键,也可以表示双键,还可以表示单键。下列有关M的推断正确的是
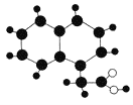
A.M的分子式为C12H12O2
B.M与足量氢气在一定条件下反应的产物的环上一氯代物有7种
C.M能发生中和反应、取代反应、加成反应
D.一个M分子最多有11个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入A(体积不变),则B的转化率_________。
(4)若降低温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________。
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
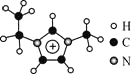
(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______;NO3-与NO2-中O-N-O的键角:NO3-____ NO2-(填“<”、“>”“=”)。
(3)EMIM+离子与金属阳离子形成的离子化合物常温下呈液态的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为___________。分子中的大π键可用符号πnm表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,则EMIM+离子中的大π键应表示为________。
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
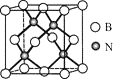
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因__________________(用离子方程式和相应的文字叙述)。
②在NaHA水溶液中各离子浓度的大小关系是_______________________________
(2)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的_____(填写物质的名称)。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________(填化学式)。
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(![]() )从大到小顺序为__________________(填序号)。
)从大到小顺序为__________________(填序号)。
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液等体积混合,则混合液的pH=_________。
(5)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

已知:
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
加入NH3·H2O调pH=8可除去______(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com