
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是
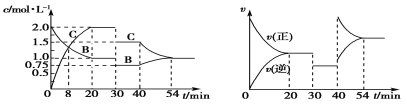
A.反应方程式中的x=1
B.该反应为放热反应
C.30 min时改变的条件是加入催化剂
D.前30 min内 A的反应速率为0.05 mol/(L·min)
【答案】AB
【解析】
由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,以此解答该题。
A.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,因正逆反应速率相等,则1+x=2,x=1,故A正确;
B.40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B正确;
C.由A可知,30min时改变的条件是减小压强,故C错误;
D.x=1,化学计量数之比等于反应速率之比,前30min内A的反应速率等于B的反应速率,v=![]() =0.042mol/(Lmin),故D错误;
=0.042mol/(Lmin),故D错误;
答案选AB。


科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
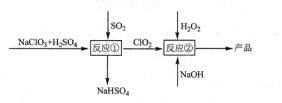
下列说法错误的是( )
A. 反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B. 若反应①通过原电池来实现,则ClO2是正极产物
C. 反应②中的H2O2可用NaClO2代替
D. 反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.焦炭可用于制备电石、生产水煤气等。完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是___________;其与水反应的化学方程式为______________________。
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为____________。氧原子的核外电子排布式为_________________。
(3)与同主族元素Mg相比,Ca的金属性更______(填“强”或者“弱”)。能证明这一结论的实验事实是________________________。
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g)。完成下列填空:
CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是____________。(选填编号)
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | C | H2 | CO | |||
1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为____________。
②下列图像正确的是________。(选填编号)
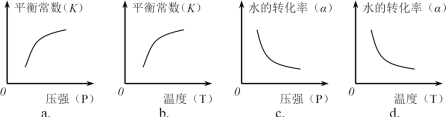
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化和液化是目前实现煤综合利用的主要途径之一。以粗煤为原料合成甲醇的流程如下:

(1)煤燃烧产生的大气污染物中,能形成酸雨的有___(填字母)。
a.SO2 b.NOx
(2)过程Ⅱ中的主要反应为:C+H2O=CO+H2,反应类型是___。
(3)过程Ⅲ中反应的化学方程式是___。
(4)将煤加工处理的意义是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现某些化合物与水反应时,其中所含的一种元素可以发生自身氧化还原反应。
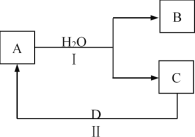
(1)若A为红棕色气体,B为强酸,C为NO。
①D为单质,其所含元素在元素周期表中的位置是___。
②下列说法中,正确的是___(填字母)。
a.A、C的组成元素相同
b.B的浓溶液可与铜反应得到A
c.A、B、C中含有化合价不同的同种元素
(2)若A为淡黄色固体,B为强碱。
①反应Ⅱ的化学方程式是___。
②若得到标准状况下气体C22.4L,则反应Ⅰ中生成B的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔性屏手机开始崭露头脚。某柔性屏手机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4 ![]() MnOOH+
MnOOH+![]() ZnSO4·3Zn(OH)2·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,正确的是
ZnSO4·3Zn(OH)2·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,正确的是

A.充电时,含有锌膜的碳纳米管纤维一端连接电源正极
B.放电时,电极的正极反应为:MnO2+e-+H+=MnOOH
C.充电时,Zn2+移向Zn膜
D.氢键是一种特殊的化学键,键能大于共价键,能使高聚物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯。目前Cl2O、ClO2、Cl2O7已能制取。
有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是____ 酸的酸酐,Cl2O电子式为____________。
(2)下列能判断Cl和O两种元素非金属性强弱的是______(选填编号)。
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是___________________________。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是________,氧化产物________。(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
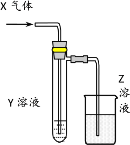
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A.d为石墨,电流从d流入导线进入铁片
B.d为铜片,铜片上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为镁片,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com