
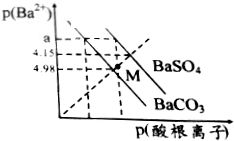
 已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )| A. | p(Ba2+)=a时,溶液中所含的c(SO42-)>c(CO32-) | |
| B. | M点对应溶液中的Ba2+、CO32-能形成BaCO3沉淀 | |
| C. | 由图可知该温度下,KSP(BaSO4)<KSP(BaCO3) | |
| D. | BaSO4淀不能转化为BaCO3沉淀 |
分析 A.p(酸根离子)越大,酸根离子的浓度越小;
B.M点不在平衡线上,是不饱和溶液;
C.a点对钡离子浓度相同,两种酸根离子浓度不同;
D.当硫酸钡悬浊液中碳酸根离子浓度足够大时,BaSO4淀能转化为BaCO3沉淀.
解答 解:A.p(酸根离子)越大,酸根离子的浓度越小,则p(Ba2+)=a时,溶液中所含的c(SO42-)<c(CO32-),故A错误;
B.M点不在平衡线上,p(Ba2+)与p(SO42-)的值均大于平衡线上的值,值越大,浓度越小,所以是不饱和溶液,故B错误;
C.a点对钡离子浓度相同,两种酸根离子浓度不同,而且c(SO42-)<c(CO32-),所以KSP(BaSO4)<KSP(BaCO3),故C正确;
D.硫酸钡悬浊液中存在钡离子,加入足量的碳酸根离子,当c(CO32-)×c(Ba2+)>KSP(BaCO3)时,会有BaCO3沉淀生成,所以硫酸钡悬浊液中碳酸根离子浓度足够大时,BaSO4淀能转化为BaCO3沉淀,故D错误.
故选C.
点评 本题考查沉淀溶解平衡,题目难度中等,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念.p(Ba2+)的值越大,钡离子浓度越小,是解题关键.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Al3+、SO42-、H+ | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | Mg2+、H+、SO42-、HCO3- | D. | Fe3+、Na+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90和18 | B. | 88和20 | C. | 90和20 | D. | 88和18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl的沉淀生成和溶解不断进行,但速率不相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 升高温度,AgCl的溶解度增大 | |
| D. | 向平衡体系中加入NaCl固体,AgCl的溶解度变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com