
| A. | AgCl的沉淀生成和溶解不断进行,但速率不相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 升高温度,AgCl的溶解度增大 | |
| D. | 向平衡体系中加入NaCl固体,AgCl的溶解度变小 |
分析 A、沉淀溶解平衡是动态平衡;
B、AgCl难溶于水,溶解度很小,但是不为零;
C、氯化银的溶解过程是吸热过程;
D、溶解度只与温度有关.
解答 解:A、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,是动态平衡,速率相等但是不为零,故A错误;
B、AgCl难溶于水,溶解度很小,但是不为零,所以溶液中含有少量的Ag+和Cl-,故B错误;
C、氯化银的溶解过程是吸热过程,升高温度溶解平衡正向移动,所以升高温度会增大AgCl的溶解度,故C正确;
D、溶解度是一定温度下,100个水所能溶解的物质质量的最大值,温度不变,溶解度不变,故D错误;
故选C.
点评 本题主要考查了沉淀溶解平衡的影响因素和平衡移动方向,物质溶解度的变化应用,题目难度不大,注意把握溶度积常数的含义与应用.


科目:高中化学 来源: 题型:选择题
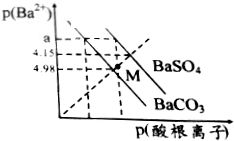 已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )| A. | p(Ba2+)=a时,溶液中所含的c(SO42-)>c(CO32-) | |
| B. | M点对应溶液中的Ba2+、CO32-能形成BaCO3沉淀 | |
| C. | 由图可知该温度下,KSP(BaSO4)<KSP(BaCO3) | |
| D. | BaSO4淀不能转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中W的最高价氧化物对应水化物的酸性最强 | |
| B. | 氢化物的热稳定性:HnY>HnW | |
| C. | Y和X、Z和X组成的常见化合物中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rW>rZ>rY>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒容通入一定量的SO2 | B. | 增大体系容积 | ||
| C. | 恒容移去部分SO3 | D. | 降低体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子不一定是金属离子,含阳离子的物质一定含阴离子 | |
| B. | 阴、阳离子相互反应不一定形成离子化合物 | |
| C. | 共价化合物均属于弱电解质 | |
| D. | 由某金属元素的阳离子和某非金属元素阴离子组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的量浓度保持不变 | B. | 各物质的量浓度相等 | ||
| C. | V逆=V正,正逆反应停止 | D. | N2、H2、NH3的速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com