
在下列条件下,能大量共存的微粒组是
化学式 | 电离常数(25℃) |
HClO | Ki=3.0ⅹ10-8 |
H2CO3 | Ki1=4.3ⅹ10-7 Ki2=5.6ⅹ10-11 |
A.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
B.上表提供的数据下:HClO 、HCO3-、ClO-、CO32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.中性的溶液中:CO32-、Na+、SO42-、AlO2-
A
【解析】
试题分析:A、由c(H+)=1×10-14mol/L可知溶液呈碱性,A组离子可以共存;B、由表中数据可知,酸性强弱顺序是H2CO3>HClO>HCO3-,因此HClO+CO32-=ClO-+HCO3-所以HClO与CO32-不能大量共存;C、能与Al反应生成H2的溶液可能是酸性溶液也可能是碱性溶液,当溶液为酸性溶液时NO3-具有氧化性,能与I‑发生氧化还原反应,不能大量存在,而当溶液为碱性溶液时NH4+不能大量存在,所以C不正确;D、CO32-、AlO2-只能大量存在于碱性溶液中,所以D不正确。
考点:认识离子共存,了解电离常数、盐的水解、Al的两性。
点评::下列几种情况离子不能大量共存:1)能发生复分解反应;2)能发生氧化还原反应;3)阴、阳离子双水解进行到底;4)发生络合反应的离子。同时要注意题目给出的附加条件,如:颜色、酸碱性、能和铝反应放出氢气、由水电离出的H+或OH-的浓度,Ka的值等等。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
醛类是重要的有机物。
47.1.松柏醇臭氧化反应生成的B含有醛基。

写出结构简式:B ;A 。
48.2.已知:
②醛甲+醛乙 醇+羧酸(歧化反应,简单的醛被氧化)
醇+羧酸(歧化反应,简单的醛被氧化)
醛基旁边的碳原子上的H原子叫α-H原子,比较活泼。制备季戊四醇的反应“流程”如下:

(1)写结构简式:D ;季戊四醇 。
(2)月桂酸季戊四醇酯[C12H25COOCH2C(CH2OH)3]是一种优良的中性洗涤剂, 试简述其可做洗涤剂的结构原因 。
(3)实际生产中甲醛过量,原因是 。
49.3.酯交换反应是指:酯+醇(酚)→新酯+新醇(酚)。松柏醇的一种芳香族同分异构体有以下特点:
①有邻位的2个取代基;②遇氯化铁溶液呈紫色;③发生分子内的酯交换反应,生成有六元环的内酯和甲醇,则该内酯的结构简式为 。
50.4.环己酮中α-H也比较活泼,能发生反应: ,则E的结构简式为 。
,则E的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA
B.3.6 g重水中含有的中子数为2NA
C.一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA
D.常温下,1 L 1 mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A、将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑
B、将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O
C、向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓
D、氯气通入水中:Cl2+H2O 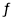 H++HClO+Cl-
H++HClO+Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:填空题
(16分)
Ⅰ、工业上用含有Cr2O72-和CrO42-的废水回收铬。其工艺流程如下:
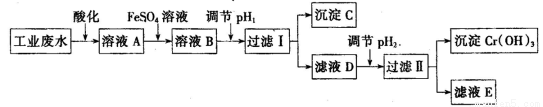
已知:①2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O;
Cr2O72-(橙色)+ H2O;
②常温下,Ksp【Fe(OH)3】=1.0×10-38,Ksp【Cr(OH)3】=1.0×10-32;
③当离子浓度小于1.0×10-5 mol·L-1时,认为沉淀完全。
(1)下列选项中能说明反应2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)= v(CrO42-)
C.溶液的颜色不变
D.溶液的PH不变
(2)为防止FeSO4溶液变质,在保存时需加入的试剂为 (填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有
(4)FeSO4溶液与溶液A发生反应的离子方程式为
(5)沉淀C的化学式为 ,pH2的范围为
Ⅱ、铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
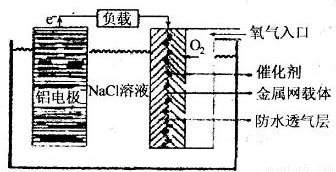
(6)该电池的总反应化学方程式为 ;
(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:填空题
[化学——物质结构与性质](15分)
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如 等。回答下列问题:
等。回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于 (填“晶体”或“非晶体”)。
(2)基态铜原子有 个未成对电子,二价铜离子的电子排布式为 ,在CuS04溶液中滴入过量氨水,形成配合物的颜色为 。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有共价键的数目为 ;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S )的沸点,其原因是 。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为 。
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为 (用含“a、NA 的代数式表示)g·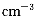 。
。

查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列过程属于物理变化的是:
A.煤的气化 B.石油分馏 C.石油裂解 D.煤的直接液化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com