
| A. | 道尔顿 | B. | 门捷列夫 | C. | 卢瑟福 | D. | 迈尔 |
科目:高中化学 来源: 题型:多选题
| A. | 等质量的金刚石与石墨完全燃烧,放出的能量一样多 | |
| B. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量少 | |
| C. | 石墨不如金刚石稳定 | |
| D. | 金刚石不如石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊试液变红 | |
| B. | 与铜反应放出NO气体生成Cu(NO3)2和H2O | |
| C. | 与Na2CO3反应放出CO2气体生成NaNO3和H2O | |
| D. | 与S单质混合共热时生成H2SO4和NO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
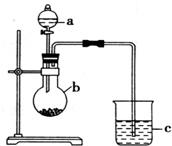 “元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:
“元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | pH=10的Na2CO3溶液:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+$\frac{1}{2}$c(C2O42-) | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①②⑥ | C. | ②③④⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com