
【题目】欲除去下列物质中混入的少量杂质(括号内物质为杂质),能达到目的的是
A. 乙酸乙酯(乙酸):加入饱和碳酸钠溶液,充分振荡静置后,分液
B. 苯(苯酚):加入浓溴水,过滤
C. 乙醇(水):加入金属钠,蒸馏
D. 乙烷(乙烯):通入酸性高锰酸钾溶液,洗气
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)填充物用60℃温水溶解,目的是_________。
(2)铜帽溶解完全后,可采用______方法除去溶液中过量的H2O2。
(3)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。其正极的电极反应式为______________。
(4)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_______。
②在pH为12~14条件下,KMnO4溶液吸收Hg的化学方程式________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀破酸、稀草酸,并不断搅拌至无气泡为止。主要反应为: 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1mol MnO(OH)参加反应时,共有______mol电子发生转移。
②已知:MnCO3和Mn(OH)2的Ksp分别是9×10-11、4×10-14。工业上向上述所得的MnSO4溶液中加入NH3和NH4HCO3来制备碳酸锰, 若溶液中Mn2+为1.0mol·L-1,为尽可能多的获得高纯碳酸锰,应控制溶液中c(CO32-)_______≥mol·L-1,过程中应控制pH<_______。[Mn2+沉淀完全;lg2=0.3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙是一种重要的化工原料,制备CaBr2·2H2O 的主要流程如下:
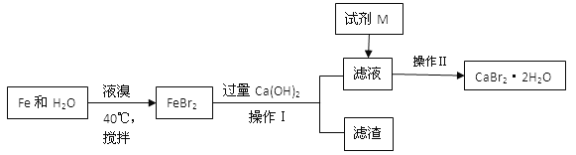
下列说法不正确的是
A. 试剂M 是HBr,加入HBr的目的是除去过量的Ca(OH)2
B. 操作I为过滤,滤渣为Fe、Fe(OH)2和Fe(OH)3;操作Ⅱ为重结晶,具体操作步骤为蒸发浓缩、冷却结晶、洗涤、干燥
C. 制得的CaBr2·2H2O 可以通过以下方法测定纯度:称取一定量的样品溶于水,滴入足量Na2CO3 溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,计算便得出CaBr2·2H2O的纯度
D. 工业上也可以将氨气通入石灰乳,并加入溴,于65℃进行反应,制得溴化钙,此反应中还会生成一种无色气体,该反应的化学方程式为3Ca(OH)2+3Br2+2NH3 ![]() 3CaBr2+N2+6H2O
3CaBr2+N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W是合成某药物的中间体,其结构简式如下:
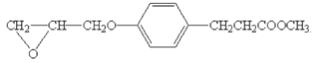
以有机物T为原料合成W的流程如图(部分条件省略):
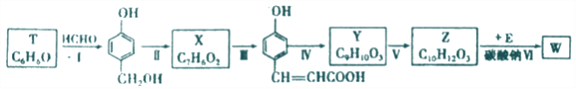
己知:RCH2ONa+CH3CH2X![]() RCH2OCH2CH3+NaX
RCH2OCH2CH3+NaX
请回答下列问题:
(1) Y中所含的官能团有_______.
(2)步骤Ⅵ中Na2CO3的作用为_______。
(3)请写出下列各步骤的反应类型:Ⅰ.__________;Ⅱ._________;Ⅴ.__________。
(4)利用步骤I的反应物,可制备某线型结构高分子,请写出相关化学反应方程式__________。
(5)物质X 最多可消耗H2______mol ,最终产物与足量HCOOH 完全反应的方程式为_______ 。
(6)写出同时满足下列条件的Y的所有同分异构体的结构简式:_______。
① 苯环上只有一个取代基
② 等量有机物分别与足量钠、足量碳酸氢钠溶液反应产生气体的物质的量相等
③ 在核磁共振氢谱图上有7个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法(括号内为杂质)正确的是( )
A.乙醇(水) 加新制的生石灰,过滤
B.乙烷(乙烯) 通过溴的四氯化碳溶液,洗气
C.溴苯(苯) 加水,振荡静置后分液
D.乙酸乙酯(乙酸) 加饱和Na2CO3溶液,振荡静置后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害。研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显______性(填“酸”、“碱”或“中”),用化学平衡原理解释:__________。
③当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

写出HSO3-在阳极放电的电极反应式:____________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
(2)用CH4催化还原NO2可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g); ΔH=-574 kJ mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g):ΔH=-1160 kJ mol-1
若用标准状况下4.48 L CH4还原 NO2至N2,整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g) + H2O(g) ![]() CO2(g) + H2(g): ΔH<0
CO2(g) + H2(g): ΔH<0
—定条件下,将CO(g)与H2O(g)以体枳比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为丨:6,则平衡常数K=__________(计算结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物的说法正确的是( )
A. 俗语“真金不怕火炼”说明某些金属在高温的条件下也不与氧气发生反应
B. Na2O为淡黄色固体,MgO为白色固体
C. 铁不与冷、热水反应,高温下也不与水蒸气发生反应
D. 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各小题中的问题(NA用6.02![]() 1023mol-1来计算)
1023mol-1来计算)
(1)1.806×1023个KClO3中K+和ClO3-的物质的量之比为______。
(2)0.1molNa2SO4中约含有_________个Na+。
(3)与34gNH3含有相同原子数的H2O的物质的量为:_______________。
(4)32gCH4中含有________mol质子。
(5)1.806×1023个H2SO4中含氧原子的物质的量为________mol。
(6)1个氧原子质量为ag,则1mol O的质量为______g。
(7)2gH2与1molSO2原子数目之比:_______________。
(8)在标准状况下,与1.7gNH3含有相同原子数的CO的体积为:_______________。
(9)在标准状况下,在1.12LCH4含有相同原子数的H2O分子的个数为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6mol·L-1硫酸、6mol·L-1盐酸和蒸馏水)

回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________________。
(2)装置B的作用是_______________________,装置C的作用是___________________。
(3)装置D中发生反应的化学方程式是______________________________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com